Забор материала на гн флору и чувствительность к антибиотикам скрытые инфекции оформление бланков
Обновлено: 11.05.2024
Для чего нужен анализ на чувствительность к антибиотикам
Микроорганизмы по отношению к конкретному виду антибиотика могут характеризоваться как чувствительные, условно-устойчивые и устойчивые. Чувствительными патогенными микроорганизмами являются те, что подавляются рекомендованными дозами антибактериального препарата. Условно-устойчивые для подавления требуют увеличение дозы. Активность устойчивых патогенных микроорганизмов не подавляется даже повышенными дозами антибиотика.
Чувствительность микрофлоры к антибиотикам индивидуальна: у разных людей бактерии могут реагировать на одни и те же антибиотики по-разному. Поэтому назначение антибактериальных препаратов на основании лишь среднестатистической картины не всегда дает желаемый лечебный эффект. Между тем любой антибиотик – это серьезное лечебное средство, обладающее побочными действиями. В частности, при его применении гибнут не только патогенные бактерии, но и полезные микроорганизмы. Может получиться ситуация, когда антибиотик уничтожит полезную микрофлору, а возбудитель заболевания не пострадает – по причине его устойчивости к данному антибиотику.
Чтобы обеспечить эффективность проводимого курса антибактериальной терапии, врач должен быть уверен, что назначаемый им антибиотик действительно справится с выявленным возбудителем заболевания. Для этого и нужен анализ на чувствительность к антибиотикам.
Когда назначается анализ на чувствительность к антибиотикам
Анализ на чувствительность микрофлоры к антибиотикам назначается, если необходимо:
- определить наиболее эффективно действующий препарат. Чаще всего анализ на чувствительность к антибиотикам назначается при лечении ЗППП, но необходимость в нем может возникнуть и при лечении других инфекционных заболеваний;
- избежать «привыкания» патогенных микроорганизмов к антибиотику – в случаях повторного использования антибактериальной терапии в течение ограниченного периода времени;
- заменить один препарат на другой, например, в случае проявления аллергической реакции.
Как делается анализ на чувствительность к антибиотикам

АО Семейный доктор - Определение чувствительности бактерий к антибиотикам
Для анализа используется различный биологический материал – в зависимости от заболевания это может быть моча, кал, мазок (из влагалища, уретры, с задней стенки глотки), грудное молоко, мокрота, слюна, и т.д.
Анализ на чувствительность к антибиотикам относится к культуральным (микробиологическим) исследованиям. Поэтому другое его название – посев на чувствительность к антибиотикам.
В «Семейном докторе» для анализа чувствительности к антибиотикам используется также автоматический анализатор Vitek, обеспечивающий высокую стандартизацию и компьютеризацию исследования.автоматический анализатор
Сколько времени занимает анализ на чувствительность к антибиотикам

Автоматический анализатор
В зависимости от метода анализа результаты анализа поступают к врачу через 2-3 дня после сдачи материала в лабораторию.
Как долго действительны результаты анализа на чувствительность к антибиотикам
Анализ на чувствительность к антибиотикам действителен только в период заболевания, по поводу которого он был назначен, и до начала антибиотикотерапии. То есть пока не началось лечение антибиотиками, картина остаётся та же, но само лечение может сказаться на чувствительности патогенных организмов к применяемым антибиотикам. Поэтому в случае повторного заболевания анализ может быть назначен снова.
Подготовка к анализу на чувствительность к антибиотикам
Необходимо соблюдать стандартные требования для сдачи каждого вида биологического материала:
- при сдаче мочи собирается средняя порция (первая порция мочи пускается в унитаз). Моча собирается в стерильный контейнер. Перед сбором мочи обязательны гигиенические процедуры;
- грудное молоко собирается до кормления ребенка. Первая порция молока из каждой груди сбрасывается, следующие 0,5-1 мл молока из каждой груди собираются в отдельный стерильный контейнер;
- перед забором мазка из зева и носоглотки не следует есть (в течение 4-5 часов до сдачи анализа);
- если вы сдаете мазок из влагалища, уретры или секрет простаты, желательно воздержаться от половой жизни (в течение 1-2 дней до сдачи анализа).
Где сдать анализ на чувствительность к антибиотикам в Москве
Сделать анализ на чувствительность к антибиотикам (посев на чувствительность к антибиотикам) в Москве Вы можете в АО «Семейный доктор». Сдать биологический материал анализ можно в любой из поликлиник компании.
Оставьте телефон –
и мы Вам перезвоним
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Метод исследования заключается в посеве отделяемого из различных отделов половой системы, а также из всех патологических очагов (язв, папул, везикул, ран и т.п.) на искусственные питательные среды.
Полученный материал можно хранить в холодильнике не более 2-х часов.
Цель:
возбудителя, его биологических свойств при острых и хронических воспалительных процессах гениталий;
определение его чувствительности к антибиотикам.
Противопоказания: кровяные выделения из половых путей.
1. Материальные ресурсы:
§ Стерильная пробирка с сухим ватным тампоном на проволоке (пробирка плотно закрыта пробкой).
Методика выполнения медицинской услуги.
2.1 Подготовка к процедуре:
o Получить информированное согласие пациентки на процедуру.
o Провести психологическую подготовку (успокоить пациентку).
o Постелить пеленку.
o Предложить пациентке лечь на гинекологическое кресло.
o Заполнить направление в лабораторию, подписать пробирку.
o Обработать руки одним из способов.
o Обработать вульву дезинфицирующим раствором.
o Надеть стерильные перчатки.
2.2 Выполнение процедуры:
· С помощью тампона на корнцанге удалить слизь с шейки матки.
· Взять закрытую пробирку в левую руку, а затем правой рукой извлечь тампон из пробирки.
· Ввести тампон на проволоке, не касаясь стенок влагалища, в цервикальный канал, произвести вращательные движения.
· Осторожно, не касаясь наружных поверхностей, поместить тампон в пробирку, плотно закрыть.
· Провести дезинфекцию рабочего места, снять и замочить перчатки, вымыть руки.
Дополнительная информация:
- материал надо брать до начала антибактериальной терапии или через 8 - 10 часов после введения последней дозы антибиотика.
Забор материала на урогенитальные инфекции (ПЦР – диагностика)
Цель:
- выявление заболеваний, передающихся половым путем.
Противопоказания: кровяные выделения из половых путей.
1. Материальные ресурсы:
§ Микропробирка с транспортной средой.
§ 2 одноразовых эндобранша в стерильной упаковке.
Методика выполнения медицинской услуги.
2.1 Подготовка к процедуре:
o Получить информированное согласие пациентки на процедуру.
o Провести психологическую подготовку (успокоить пациентку).
o Постелить пеленку.
o Предложить пациентке лечь на гинекологическое кресло.
o Вскрыть упаковки с эндобраншами.
o Обработать руки одним из способов.
o Обработать наружные половые органы дезинфицирующим раствором.
o Надеть стерильные перчатки.
2.2 Выполнение процедуры:
· Развести половые губы левой рукой.
· Ввести эндобранш в уретру, круговыми движениями получить материал.
· Ввести полученный материал в микропробирку с транспортной средой.
· С помощью тампона на корнцанге удалить слизь с шейки матки.
· С помощью корнцанга извлечь эндобранш.
· Ввести эндобранш в цервикальный канал, с помощью круговых движений получить материал
· Внести полученный материал в ту же пробирку с транспортной средой.
· Заполнить направление в лабораторию.
· Провести дезинфекцию рабочего места, снять и замочить перчатки, вымыть и высушить руки.
Запомните: полученный материал хранится в холодильнике не более 2-х часов.
В документированной процедуре изложены правила сбора и транспортирования биологических материалов в лабораторию клинической микробиологии (бактериологии) ГОБУЗ “Мурманская областная клиническая больница им. П. А. Баяндина” в целях повышения качества результатов лабораторных исследований и организации противоэпидемических и профилактических мероприятий, а также профилактики внутрибольничных инфекций у медицинского персонала и пациентов.
Документированная процедура предназначены для использования в МОКБ, а также может использоваться организациями, направляющими заказ на услугу по лабораторной диагностике.
Общие положения
Предложенная техника сбора и транспортирования биологических материалов в ЛКМ МОКБ позволит снизить уровень преаналитической ошибки и повысить качество работы лаборатории по объективизации результатов.
Документированная процедура определяет правила предохранения медицинского персонала и пациентов от инфицирования при сборе и доставке в лаборатории проб биоматериалов, которые могут быть обсеменены бактериями, грибами, вирусами, паразитами.
Общие требования к сбору проб биоматериала для микробиологического исследования
Материал для исследования собирают в достаточном количестве.
Материал должен соответствовать характеру инфекционного процесса.
При сборе материала необходимо использовать только стерильные инструменты и посуду, соблюдая правила асептики для исключения контаминации (загрязнения) биопробы нормальной микрофлорой, т.к. ее наличие приводит к ошибочной трактовке результатов.
При сборе биоматериала медперсонал обязан использовать средства индивидуальной защиты (далее - СИЗ) (перчатки, маска, шапочка, очки и др.).
Необходимо осуществлять сбор биоматериала только в рекомендуемые транспортные среды и контейнеры.
Материал для исследования, по возможности, собирают до начала антибактериальной терапии. При отсутствии такой возможности собирают, непосредственно, перед повторным введением (приемом) препаратов.
В бланке направления на исследование в обязательном порядке указывают наименование принимаемых антибактериальных препаратов.
Не допускается загрязнение наружную поверхность посуды при сборе и доставке проб.
Не допускается загрязнение сопроводительных документов (направлений).
При сборе биоматериала в пробирки, необходимо использовать штативы.
После взятия биоматериала, необходимо сделать запись о процедуре в бланке направления: дату, время взятия, другую информацию.
Правила маркировки проб биоматериала для микробиологического исследования
Все биопробы, поступающие в лабораторию должны пройти процедуру штрих-кодирования.
Наклейки, с нанесенными штрих-кодами, получают в централизованной многофункциональной лаборатории (далее ЦМЛ) МОКБ.
Цель штрих-кодирования - идентификация пациента (на пробирке (контейнере, флаконе) и на бланке должен быть одинаковый номер штрих-кода).
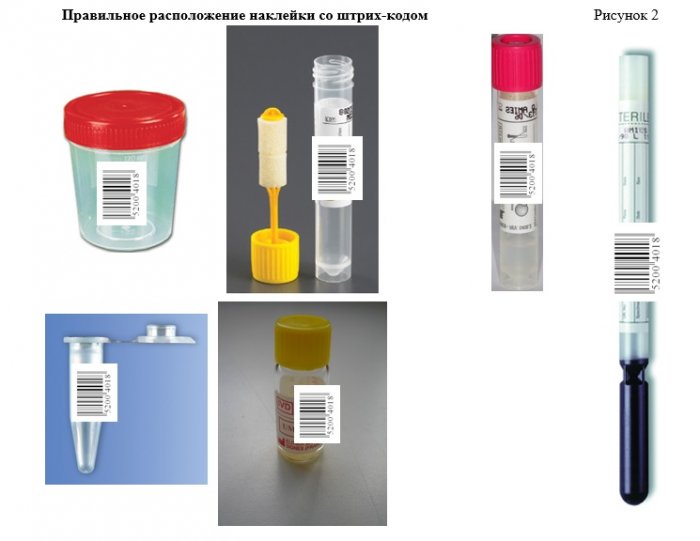
Штрих-код наклеивают на пробирку (контейнер, флакон) строго вертикально цифровой надписью сверху вниз, на имеющуюся наклейку. Необходимо оставить прозрачную зону для контроля состояния биопробы. Штрих-коды, наклеенные неровно, не будут считываться сканерами приборов.
Штрих-код должен быть наклеен ровно и плотно, строго вертикально (длинной стороной вдоль пробирки, контейнера) (рисунок 2).
При маркировке контейнера штрих-код наклеивается непосредственно на сам контейнер, на крышку маркировка не наносится.
Рекомендуется двойная маркировка - помимо штрих-кодирования, на емкость для сбора наносится краткая запись (номер, фамилия, уточнение локализации биоматериала и др.).
Выбор лент со штрих-кодами определяется количеством пробирок, контейнеров для исследований одного пациента, с учетом штрих-кодирования бланка направления (не менее 2-х штрих кодов на ленте: 1-й-на пробирку, 2-й на бланк).
Весь биоматериал маркируется двойными штрих-кодами.
Исключение для исследования:
(63037) «Микробиологическое исследование крови и других стерильных в норме жидкостей на микрофлору»
Необходимо использовать тройной штрих-код:
1 – направление-бланк на исследование
2 – аэробный флакон
3 – анаэробный флакон

Общие требования к условиям хранения проб биоматериала до доставки в лабораторию
Соблюдайте условия хранения биопроб до доставки в лабораторию (таблица 1).
Рекомендуется организовать в отделениях медицинской организации место хранения биопроб до их отправки в лабораторию (таблица 2).
Место хранения биопроб должно иметь маркировку знаком «Биологическая опасность».
Биопробы необходимо хранить в закрывающихся контейнерах, имеющих маркировку знаком «Биологическая опасность».
Регулярно проводите дез.обработку места хранения биопроб, контейнеров.
Сопроводительные документы (бланки направлений на исследования) помещают в пластиковый пакет (файл) для исключения контакта с биоматериалом.
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Рекомендации по организации места хранения биопроб до доставки в лабораторию
Температурный режим хранения, и др.
Место хранения биопроб
при комнатной температуре
(18—20°С), в тёмном месте
Закрытый «холодный» шкаф, тумбочка вдали от отопительных приборов
В закрытом контейнере для доставки
при температуре 2-8 0 С
В термоконтейнере с хладоэлементами
при температуре 37 0 С
В контейнере с термоэлементами, нагретыми до необходимой температуры (грелка, обернуть одноразовой пеленкой, ветошью)
Общие требования к доставке проб биоматериала для микробиологического исследования
Доставка проб биоматериала осуществляется в рабочие дни и время ЛКМ (бактериологии), согласно режиму доставки в ЛКМ.
Исключение составляет круглосуточный прием от отделений МОКБ следующих биоматериалов:
Пробы ликвора - для проведения реакции латекс-агглютинации и бактериологического посева.
Пробы крови - для посева на стерильность.
Собранный материал доставляют в лабораторию в рекомендуемые сроки (таблица 1).
Доставка биоматериала осуществляется курьером.
Не допускается доставка биоматериала пациентами.
Для доставки биоматериала необходимо использовать закрывающиеся контейнеры, биксы или сумки-холодильники, обязательна маркировка знаком «Биологическая опасность».
Не допускается доставка биоматериала в руках, карманах, хозяйственных сумках и других предметах личного пользования.
Дно контейнеров должно быть покрыто сухим адсорбирующим материалом (марлевая салфетка, ткань, вата и пр.).
Доставляемые емкости с биоматериалами должны быть закрыты пробками, крышками, исключающими выливание содержимого во время транспортирования.
Доставка жидкого биоматериала осуществляется строго в вертикальном положении, в штативах.
Сопроводительные документы (бланки направлений на исследования) помещают в непромокаемый пакет (файл, папка) для исключения контакта с биоматериалом.
Разбор доставленного биоматериала должен проводиться с соблюдением мер предосторожности. Емкости с биоматериалами должны помещаться на поднос или лоток. Персонал должен использовать средства индивидуальной защиты (резиновые перчатки, маску).
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Правила по сбору, доставке и хранению различных проб биоматериала для микробиологического исследования
Пробы при инфекционно-воспалительных процессах дыхательных путей
Пробы при инфекционно-воспалительных процессах мочеполовой системы
Общие требования к сбору, хранению и доставке проб биоматериала для ПЦР-диагностики
Правила по сбору, доставке и хранению различных проб биоматериала для ПЦР-диагностики
Метод определения Исследование проводят методом посева на плотные питательные среды и среду обогащения ручным методом. Идентификацию микроорганизмов проводят методом масс-спектрометрии с помощью прибора Microflex Brucker Daltonik MALDI Biotyper, BRUKER, Германия. Определение чувствительности к антимикробным препаратам проводят диско-диффузионным методом с использованием анализатора ADAGIO, BIO-RAD, Франция.
Краткое описание исследования «Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам»
Микробиологическое исследование материала из ран направлено на выделение возбудителей с доказанной этиологической значимостью.
Инфекции кожи и мягких тканей (ИКМТ) являются обычно бактериальными и во многих случаях – полимикробными. Бактерии, которые чаще всего участвуют в процессе, – это Staphylococcus aureus, Streptococcus spp. (Streptococcus pyogenes и в меньшей степени – стрептококки групп В, С
Антибиотики относятся к лекарственным препаратам, эффективность которых является наиболее очевидной для лечения бактериальной инфекции. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения.
Учитывая наличие указанных проблем, антимикробный препарат следует назначать только при наличии обоснованных показаний (подтвержденная или предполагаемая бактериальная инфекция) и с учетом результатов определения чувствительности к нему выделенного возбудителя.
Выделяемые микроорганизмы и возбудители:
- Streptococcus pyogenes (бета-гемолитический стрептококк группы А, БГСА), реже гемолитические стрептококки других групп (B, C, G);
- Staphylococcus aureus;
- Pasteurella multocida (при укусах);
- Enterococcus spр.;
- энтеробактерии;
- неферментирующие грамотрицательные бактерии (Pseudomonas aeruginosa и др.);
- дрожжевые грибы (Candida spp.).
ВАЖНО! Данное исследование не предусматривает обнаружение анаэробных микроорганизмов. Для полноценного обследования пациентов с укушенными ранами, угревой сыпью (глубокими угрями), паронихиями, некротизирующим фасциитом, пролежнями и газовой гангреной рекомендуется дополнительно назначать тест № 452 и бактериоскопию мазка на стекле (тест № 445).
Обращаем внимание на необходимость предварительного приобретения контейнера с транспортной средой, используемой при взятии мазков, в любом медицинском офисе ИНВИТРО.
С какой целью проводят Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам
Целью микробиологического исследования раневого отделяемого и тканей является подтверждение либо опровержение предположения о наличии инфекционного процесса в ране, а в случае его наличия – выявление ведущего патогена – определение его чувствительности к антимикробным препаратам для назначения или коррекции антибиотикотерапии.
Что может повлиять на результат теста «Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам»
Материал для исследования
- Отделяемое из зубодесневого кармана
- Содержимое абсцесса
- Экссудат
- Содержимое инфильтрата
- Транссудат
- Отделяемое раны
- Гной
- Мазок с языка
- Мазок со слизистой щек, губ, десен
- Отделяемое из хирургического дренажа
Важным моментом является способ получения клинического материала. Наиболее достоверные данные получают при исследовании биопсийного интраоперационного материала. Высокой степенью достоверности обладают результаты аспирационной биопсии. Соскоб или мазок из раны имеют в этом отношении наименьшую диагностическую ценность вследствие возможной посторонней контаминации.
Клинически наиболее значимые микроорганизмы будут выделяться из образцов, полученных в пределах жизнеспособных тканей (в области грануляционного вала).
В этих образцах, в гнойном отделяемом и на поверхностных участках ран обсемененность может быть различной.
Гной может не содержать жизнеспособных микроорганизмов в связи с аутолизом микробных клеток, что ведет к получению отрицательного результата посева.
При использовании микробиологического метода в качестве критерия оценки эффективности и достаточности антибактериальной терапии в динамике необходимо соблюдать одинаковую методику забора материала.
Правила подготовки к исследованию «Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам»
В каких случаях проводят Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам:
- инфекции кожи и мягких тканей (фурункулы, карбункулы, абсцессы, флегмоны и т. д.), инфицированные раны, ожоги, остеомиелит и другие гнойной-воспалительные хирургические инфекции у пациентов молодого возраста без сопутствующих заболеваний, ранее не получавших антибиотикотерапию;
- необходимость подбора антибиотиков для лечения.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Трактовка результатов исследования «Посев раневого отделяемого и тканей на микрофлору и определение чувствительности к антимикробным препаратам»
Результат содержит информацию о наличии или отсутствии роста микроорганизмов, в т. ч. дрожжевых грибов, их количестве (кроме случаев, когда рост получен только со среды обогащения, когда точная количественная оценка невозможна), родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий и условно-патогенных микроорганизмов в диагностическом титре проводят определение чувствительности к стандартному спектру антимикробных препаратов.
Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию необходимо заказать тест № 442 ).
В случае роста в образцах сопутствующей микрофлоры (стрептококки группы viridans, Corynebacterium spр., коагулазонегативные стафилококки и др.) в низком титре на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к сопутствующей флоре; в этих случаях определение чувствительности к антимикробным препаратам не проводится. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено». В случае роста микроорганизмов, для которых отсутствует стандартизованная методика определения чувствительности и критерии оценки, определение чувствительности невозможно, о чем дают соответствующие комментарии.
Дозаказ определения чувствительности к расширенному спектру АМП и бактериофагам не возможен, для этой цели назначают тесты № 474-Р, № 474-Ф.
Интерпретация
Учитывая высокую вероятность колонизации собственными микроорганизмами и микроорганизмами кожи и раневой поверхности в результате попадания бактерий из окружающей среды или эндогенно, следует признать, что выделение микроорганизмов из раны является ожидаемой закономерностью. Следовательно, само по себе обнаружение в ране микроорганизмов не может служить подтверждением наличия инфекции. Важнейшим критерием наличия инфекционного процесса в ране является клиническая картина. Выделение того или иного микроорганизма (или ассоциации микроорганизмов) на фоне отека, гиперемии области раны при остром процессе с большой вероятностью свидетельствует об инфекции. С другой стороны, слабовыраженные или отсутствующие признаки воспаления свидетельствуют в пользу контаминации. В случае хронических длительно существующих вторичных ран диагностические критерии инфекции более затруднительны вследствие вялотекущего воспалительного процесса.
В случае длительно существующей вторичной ИКМТ (инфекции диабетической стопы, хронические инфицированные трофические язвы и т. д.) нередким становится выделение ассоциации микробов, определение ведущей этиологической роли одного из которых становится подчас невыполнимой задачей. Показано, что определение чувствительности к антибиотикам необходимо только для двух, максимум трех наиболее вероятных патогенов, выделенных в ассоциации.
В патогенезе раневых инфекций основное значение имеют высоковирулентные микроорганизмы, вызывающие дополнительное повреждение тканей и существенно замедляющие репарацию ран. К таким микроорганизмам относят S. aureus, S. pyogenes, P. aeruginosa и энтеробактерии. При хронических ранах признаком инфекции и показанием для проведения антибактериальной терапии служит выделение S. aureus и P. aeruginosa.
При инфекциях кожи и мягких тканей достаточно часто выделяют Enterococcus spp., в основном Enterococcus faecalis, а также коагулазонегативные стафилококки. Указанные виды бактерий в большинстве случаев выделяют в составе различных ассоциаций и практически никогда – в виде монокультуры. В этой связи самостоятельная этиологическая роль этих микроорганизмов при инфекциях кожи и мягких тканей, а также костей и суставов подвергается сомнению.
Отсутствие роста бактерий не исключает наличия инфекций, вызванных микроорганизмами, которые не могут быть выделены в рамках данного исследования, в частности, анаэробами.
Исследование проводят методом посева на плотные питательные среды с использованием прибора WASP, Copan, Италия. Идентификацию микроорганизмов проводят методом масс-спектрометрии с помощью прибора Microflex Brucker Daltonik MALDI Biotyper, BRUKER, Германия. Определение чувствительности к антимикробным препаратам проводят диско-диффузионным методом с использованием анализатора ADAGIO, BIO-RAD, Франция; определение чувствительности к бактериофагам – путем посева бактериальной культуры на плотную питательную среду с последующим нанесением бактериофага.
Бактериологическое исследование биоматериала с целью выделения и идентификации условно-патогенных микроорганизмов – возбудителей неспецифических инфекционно-воспалительных заболеваний урогенитального тракта − с определением чувствительности выделенных патогенов к стандартному спектру антимикробных препаратов (антибиотиков, АМП) и бактериофагам.
Синонимы: Genitourinary tract Culture, Routine; Antibiotic Susceptibility and Bacteriophage Efficiency testing.
Краткое описание исследования «Посев отделяемого половых органов на микрофлору, определение чувствительности к антимикробным препаратам и бактериофагам»
Микроорганизмы, составляющие нормальную микрофлору мочеполовой системы, составляют её биоценоз. У женщин детородного возраста микробная флора влагалища представлена строгими и факультативными анаэробными микроорганизмами (к ним в большей степени относятся лактобациллы) и значительно в меньшей степени аэробными и микроаэрофильными условно-патогенными бактериями. Другие отделы (полость матки, внутренний канал шейки матки) стерильны.
У девочек до наступления полового созревания преобладает кокковая флора и грамположительные палочки (дифтероиды).
У здоровых мужчин дистальные отделы уретры контаминированы грамположительными кокками и палочками в небольшом количестве. Проксимальные отделы уретры, простата и семявыводящие канальцы стерильны.
Изменение численности того или иного вида микроорганизмов или появление несвойственных данному месту обитания бактерий ведут к возникновению признаков инфекционно-воспалительных заболеваний.
Данный метод включает в себя качественное и полуколичественное бактериологическое исследование биоматериала с целью выделения и идентификации возбудителей инфекционно-воспалительных заболеваний неспецифического характера и определение чувствительности выделенных микроорганизмов к антимикробным препаратам (антибиотикам, АМП).
Антибиотики относятся к лекарственным препаратам, эффективность которых является наиболее очевидной для лечения бактериальной инфекции. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения.
Учитывая наличие указанных проблем, антимикробный препарат следует назначать только при наличии обоснованных показаний (документированная или предполагаемая бактериальная инфекция) и с учетом результатов определения чувствительности к нему выделенного возбудителя.
В ряде случаев, в условиях растущей антибиотикорезистентности, а также для пациентов, имеющих противопоказания к приему антибиотиков, актуальной альтернативой антибактериальным препаратам служат бактериофаги. В медицине используют их способность разрушать клетки болезнетворных микроорганизмов. Литическое действие бактериофагов строго специфично. В производстве фаговых препаратов учитывают специфичность бактериофагов и готовят поливалентные фаговые препараты – смеси бактериофагов, активных в отношении различных типов возбудителей. При применении бактериофаги не нарушают нормального биоценоза человека, могут применяться в комплексной терапии с другими лекарственными средствами. Бактериофаги не вызывают дисбиоз, аллергию, не подавляют иммунную систему; разрешены к применению у детей с 0 месяцев, у беременных и в период лактации. При необходимости использования бактериофагов в лечебных и/или профилактических целях необходимо проводить оценку чувствительности к ним возбудителя.
- условно-патогенные микроорганизмы: энтеробактерии, неферментирующие грамотрицательные бактерии, стрептококки, энтерококки, стафилококки, коринеформные бактерии и дрожжеподобные грибы.
С какой целью проводят посев отделяемого половых органов на микрофлору, определение чувствительности к антимикробным препаратам и бактериофагам
Исследование проводят для определения бактериальной природы инфекционно-воспалительного заболевания неспецифического характера, обоснования рациональной антибиотикотерапии и подбора препаратов бактериофагов.
Читайте также:

