Установка стена в поджелудочной железе
Обновлено: 03.05.2024
Стентирование желчных протоков – процедура по установке эндопротеза в просвет желчных протоков для восстановления их проходимости. Она чаще всего проводится при механической желтухе опухолевого происхождения. Обычно стентирование становится вторым этапом лечения, так как на первом этапе требуется декомпрессия желчевыводящих путей – она выполняется разными способами и ставит целью устранение или снижение тяжести желтухи. После этого в желчевыводящие пути устанавливают стент, чтобы желтуха не развилась повторно. Двухэтапный подход к лечению обеспечивает низкий риск осложнений.
Зачем делают стентирование
Только у 20% пациентов с раком печени, желчных протоков и поджелудочной железы проводится радикальная хирургическая операция для удаления опухоли. Остальным показано лишь паллиативное лечение. Даже после радикальных операций у большинства больных рак рецидивирует.
Одной из основных задач паллиативного лечения является устранение или предотвращение развития механической желтухи. Для этого требуется обеспечить нормальный отток желчи. Достичь этой цели можно двумя методами:
- хирургические операции, направленные на формирование обходного пути для оттока желчи в кишечник;
- малоинвазивные процедуры по восстановлению проходимости желчных протоков и профилактике повторного опухолевого стеноза.
Стентирование желчных протоков – малоинвазивный метод лечения, который у многих пациентов позволяет избежать большой операции.

- Принимаем пациентов 24/7
- Стабилизация состояния, реанимация, медицинский уход
Варианты стентирования
В медицине используется два вида стентирования, в зависимости от операционного доступа:
- эндоскопическое (ретроградное) стентирование – выполняется через двенадцатиперстную кишку (инструменты вводятся в неё через ротовую полость);
- чрескожное (антеградное) стентирование – через прокол на животе.
В некоторых случаях используются сразу оба доступа.
Методики установления стента являются не конкурирующими, а взаимодополняющими. В разных ситуациях может быть предпочтительным тот или иной способ.

Главный врач, онколог-хирург
Доктор медицинских наук
Опыт работы: Более 30 лет
Варианты стентов
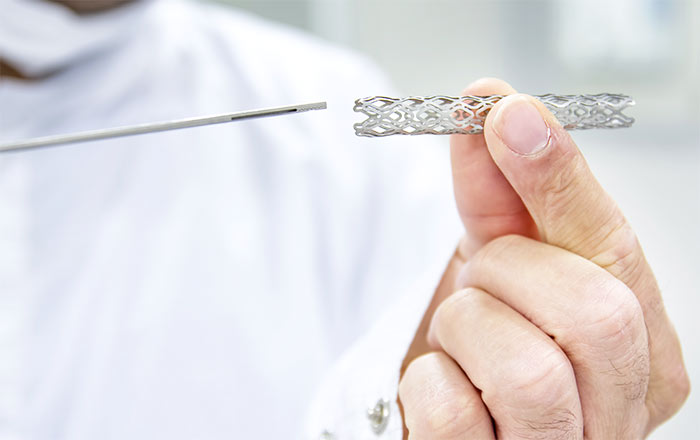
Для стентирования применяются пластиковые или металлические стенты. Пластиковые применяются редко и являются временными. Они имеют короткий срок службы из-за формирования бактериальных биопленок и отложения камней, состоящих из солей желчных кислот.
Металлические стенты бывают с покрытием и без покрытия. Стенты без покрытия недолговечны: через ячейки стента прорастает опухолевая ткань и повторно блокирует желчевыводящие протоки. В итоге желтуха может развиться повторно уже через несколько недель.
В клинике НАКФФ применяются саморасправляющиесянитиноловые стенты с полимерным покрытием. Он вводится в сложенном виде, а внутри желчных протоков стент расправляется, и его диаметр увеличивается в 3-4 раза. Это важно для обеспечения длительности эффекта: чем больше диаметр, тем меньше риск повторной опухолевой обструкции. Так как стент представляет собой ячеистую структуру, через ячейки может прорастать опухоль. Чтобы избежать этого явления, стенты покрывают тонкой пленкой из полиуретана, силикона или полиэтилена.
Лучшими считаются стенты с антирефлюксным механизмом. Они имеют клапан, который предотвращает попадание содержимого кишечника в желчные протоки. Больше половины этих стентов остаются функциональными через 1 год после установки.
Среднее время функционирования разных видов стентов до развития опухолевой обструкции:
- пластиковые – 3,5 месяцев;
- металлические без покрытия – 5 месяцев;
- покрытые стенты – 10 месяцев;
- частично покрытые с антирефлюксным механизмом – 15 месяцев.
Длину и диаметр стента врачи подбирают индивидуально, в зависимости от протяженности и локализации стриктуры (зоны сужения протока). Правильный выбор размеров снижает риск миграции стента после его установки.
Куда обратиться
Сделать стентирование желчных протоков вы можете в клинике НАКФФ. Несколько причин, почему стоит обратиться именно в наш центр:
- используются лучшие стенты, которые имеют длительный срок службы и с высокой вероятностью не потребуют замены в будущем;
- трехмерная реконструкция желчевыводящих путей с помощью КТ – позволяет идеально спланировать процедуру и выбрать лучший вариант стентирования;
- при необходимости лечение проводится в два этапа для снижения риска осложнений: стентирование выполняется после билиарной декомпрессии;
- наши хирурги применяют как эндоскопическое, так и чрескожное стентирование, а также их сочетание, что позволяет выбрать лучший вариант для каждого пациента;
- индивидуальный выбор методов желчеотделения, в зависимости от типа рака, расположения и размеров опухоли, анатомии желчных и панкреатических протоков;
- доступны другие методы лечения рака, которые дополняют стентирование желчных протоков, увеличивают продолжительность жизни пациента, предотвращают осложнения и уменьшают симптомы.
В клинике НАКФФ процедуры проводятся опытными специалистами. Они успешно выполнили уже сотни операций по стентированию желчных протоков.
Стентирование желчных протоков — это малоинвазивное хирургическое вмешательство, которое применяется для восстановления проходимости желчных протоков (ЖП) и предотвращения его повторной обтурации (закупорки).
Непроходимость желчного протока могут вызвать различные заболевания, но чаще всего это злокачественные новообразования гепато-билиарной системы, желчно-каменная болезнь, пороки развития. При невозможности нормального выделения желчи, развивается механическая желтуха — грозное состояние, которое оказывает влияние на весь организм и при отсутствии лечения может привести к летальному исходу.
Главными методами устранения непроходимости ЖП является установка стента (металлического каркасного устройства) в место сужения протока. Он поддержит стенки в расправленном состоянии и обеспечит нормальный дренаж желчи.
В настоящее время используются самораскрывающиеся металлические и пластиковые стенты. Пластиковые конструкции менее долговечные и надежные, средний срок их эксплуатации составляет около 3-х месяцев. В онкологии получили широкое распространение элютированные стенты, которые имеют лекарственное покрытие, предотвращающее прорастание в его просвет опухоли.
Показания
- Злокачественные опухоли гепато-билиарной системы:
- Рак печени.
- Рак 12-перстной кишки.
- Рак фатерова сосочка.
- Рак поджелудочной железы.
- Метастазы в печень и гепато-дуоденальную связку.
- Стенозы и стрикруры желчевыводящего протока, возникшие в результате пороков развития или предыдущих хирургических вмешательство на органах гепато-билиарной системы.
- Синдром Мириззи.
Противопоказания к стентированию желчных протоков
-
с развитием кровотечения.
- Выраженный стеноз желчного протока, при котором к нему невозможно подвести эндоскопические хирургические инструменты. (операции проводятся после купирования данного состояния).

Подготовка к процедуре
В рамках подготовки к стентированию ЖП пациент проходит комплексное обследование, которое включает ряд лабораторных анализов и инструментальных методов исследования:
- Общий и биохимический анализы крови.
- Коагулограмма — анализ, который отражает работу кровесвертывающей системы.
- Ультразвуковое исследование печени и желчевыводящих протоков.
- Ретроградная холангиография — исследование проходимости ЖП.
При необходимости проводится КТ и/или МРТ, которые позволят уточнить продолжительность стеноза и лучше спланировать проведение операции.
Разновидности стентирования
В настоящее время существует несколько техник стентирования протоков. Одни предполагают проведение всех манипуляций через просвет 12-перстной кишки. Такое вмешательство называется эндоскопическое стентирование, поскольку предполагает использование эндоскопической техники. Также стент может устанавливаться с помощью чрескожной пункции желчного протока под контролем УЗИ.
Эндоскопическое стентирование
Эндоскопическое стентирование выполняется во время проведения фиброгастродуоденоскопии (ФГДС). Сначала производится осмотр поверхности 12-перстной кишки и фатерова сосочка (места выхода общего желчного протока). После чего, в просвет протока вводится проводник, внутри которого находится стент в сложенном состоянии. Он доставляется непосредственно к месту стеноза и только после контроля правильности установки, его расправляют. Контроль осуществляют с помощью рентгена. Если имеется очень сильный стеноз, проводят балонную дилятацию протока, это позволит расширить его просвет и правильно установить стент.
Как проводится чрескожное стентирование
Сначала под контролем УЗИ производится пунктирование желчного протока. УЗИ поможет определить расширенные желчные протоки и безопасно ввести иглу в их просвет.
Далее производят дренирование и санацию протока. Затем к месту стеноза подводят специальный инструмент — интродьюсер. Он расширит проток и будет поддерживать его в таком состоянии, пока не установят стент. Стентирование производится обычным способом. В сложенном состоянии его подводят к месту стеноза, проверяют правильность расположения и только после этого производят его раздувание и фиксацию.
Результат
После проведения стентирования ЖП, восстанавливается пассаж желчи по желчным путям, и она может опять поступать в просвет кишечника. Постепенно будут уходить симптомы желтухи, снизится уровень билирубина, нормализуется пищеварение.
Возможные осложнения
- Кровотечения. Причиной развития кровотечения может быть нарушение функции свертывания крови из-за длительной желтухи, повреждение измененной опухолью стенки протока, смещение стента во время или после установки, повреждение кровеносных сосудов во время чрескожной пункции.
- Инфекционные осложнения. Из-за застоя желчи происходит активное размножение патогенной флоры, в частности анаэробной микрофлоры. Благодаря высокому давлению в желчных протоках, развивается холангио-венозный рефлюкс, при котором инфицированная желчь попадает в кровоток. Ситуация усугубляется иммунологическими нарушениями, которые возникают на фоне желтухи. В целом, чем дольше существует холестаз, тем выше инфекционные риски.
- Образование желчного затека — попадания желчи в брюшную полость. Причинами тому может быть высокое давление и нарушение целостности желчных протоков, нарушение целостности капсулы печени при проведении многократных поисковых пункций. Поскольку при механической желтухе желчь со временем инфицируется, при ее попадании в брюшную полость развивается такое грозное осложнение, как перитонит.
- Нарушение проходимости стента. Такие ситуации могут возникнуть при смещении стента, его инкрустрации желчными конкрементами, а также при прорастании опухоли внутрь его просвета. В любом из этих случаев требуется повторная операция.
Альтернативы
Как правило, стентирование желчных протоков при онкологии является временной процедурой. В большинстве случаев опухоль продолжает расти и ситуация обтурации возникает вновь. Это приводит к необходимости рестентирования и/или проведения полноценных операций на гепатобилиарной системе с удалением новообразования или наложением обходных анастамозов для желчеотведения.
Стентирование желчных протоков — это малоинвазивная операция, направленная на то, чтобы восстановить проходимость желчного протока и предотвратить его повторную обтурацию. Вызвать непроходимость могут различные заболевания гепато-билиарной системы, в частности доброкачественные или злокачественные опухоли, конкременты, спайки. Невозможность оттока желчи приводит к ее стазу, инфицированию и развитию механической желтухи.
Главным методом устранения обтурации желчного протока является его декомпрессия с помощью стентирования — установки каркасного устройства в место его патологического сужения.
Стент имеет вид металлической или пластиковой трубочки, которая состоит из ячеек. Ее вводят в место стеноза желчного протока, где под действием температуры человеческого тела или с помощью раздувания баллоном он расправляется и вжимается в стенки органа, расширяя его и создавая дополнительный каркас, препятствующий обратной обструкции.
Показания к стентированию желчных протоков:
Противопоказания
- Кровотечения из опухоли.
- Выраженное сужение желчного протока, при котором к месту обтурации невозможно подвести доставочные инструменты.
- Кишечная непроходимость.
- Спаечная болезнь кишечника.
Подготовка
В рамках подготовки больного к стентированию проводится комплексное клинико-лабораторное обследование, которое включает следующие процедуры:
- Общий и биохимический анализ крови.
- Коагулограмма.
- УЗИ печени.
- При необходимости назначается КТ или МРТ.
- Ретроградная холангиопанкреатография.
По результатам полученных данных, врач определяет оптимальный метод стентирования. При необходимости, проводят дренирование желчных протоков, а стент устанавливают вторым этапом, после нормализации состояния пациента.

Как проводится стентирование желчных протоков
Существует несколько методов проведения процедуры. Одни из них предполагают установку стента через 12-перстную кишку, другие — с помощью пункции билиарного протока под контролем УЗИ.
Как проводится эндоскопическое стентирование
Под общей анестезией выполняется фиброгастродуоденоскопия и осматривается область фатерова соска, которым общий желчный проток открывается в просвет 12-перстной кишки. В просвет этого протока вводят проводник, по которому к месту сужения подводится стент в сложенном состоянии. Правильность установки проводника и стента контролируется с помощью рентгенографии. Только после этого стент освобождается и производится его расправление. Если имеется выраженный стеноз, перед установкой стента возможна баллонная дилатация просвета протока. Это облегчит установку каркасной конструкции.
Противопоказанием к эндоскопическому стентированию желчных протоков является прорастание опухоли в соседние анатомические структуры. В этом случае проводят более расширенные операции, например, чрескожное дренирование желчных протоков или полноценную операцию на печени. И только после купирования обтурационной желтухи проводят восстановление проходимости желчных протоков путем стентирования. В этом случае проводится пункционное стентирование
Как проводится пункционное стентирование
- На первом этапе производится пункция билиарного протока под контролем УЗИ. Это позволяет визуализировать расширенные желчные протоки и безопасно ввести иглу в их просвет.
- Проток расширяют, устанавливают холангиостому и производят санацию желчных путей.
- Затем к месту стеноза подводят катетер и устанавливают интродьюсер — специальную трубку, которая расширяет проток и поддерживает его в таком состоянии.
- Затем устанавливают стент, расправляют его и фиксируют в месте обтурации. При необходимости, проводится раздувание стента с помощью баллона, в который нагнетается воздух.
- По показаниями устанавливается страховочная холангиостома.
Осложнения
Осложнения после стентирования желчных протоков можно разделить на две группы:
- Тяжелые — геморрагии, инфекции.
- Легкие — транзиторное повышение температуры, боль, холангиты без бактериального инфицирования, дислокация стента.
Кровотечения
Из интраоперационных осложнений чаще всего встречаются кровотечения (геморрагии). Предпосылкой к их развитию является длительная механическая желтуха, которая приводит к нарушению кровесвертывающей системы и наличие измененной опухолевой ткани. На этом фоне технические погрешности проведения процедуры могут спровоцировать кровотечения:
- Повреждение опухоли или инфильтрированной опухолью стенки желчного протока.
- Смещение стента при установке.
- Грубые манипуляции при катетеризации.
- Повреждение кровеносных сосудов на этапе пунктирования.
Инфекционные осложнения
К развитию инфекционных осложнений предрасполагают следующие факторы:
- Длительная желтуха.
- Повышенное давление внутри протоков, которое приводит к холангио-венозному рефлюксу и попаданию бактериальных токсинов в кровоток.
- Нарушение микрофлоры. Если нарушается отток желчи в 12-перстную кишку, изменяется состав ее бактериальной флоры, начинают активно размножаться анаэробы.
- Увеличение проницаемости стенки кишечника.
- Нарушение иммунных механизмов.
У многих больных (20–50%) при холестазе желчь инфицирована на дооперационном этапе, и при проведении стентирования процесс начинает распространяться. Вероятность развития тяжелых септических осложнений определяется продолжительностью желтухи. Чем дольше существует стаз, тем выше риски. Поэтому абсолютно всем пациентам, идущим на операцию, показан прием антибиотиков.
Попадание желчи в брюшную полость
Возникновение желчного затека может быть обусловлено следующими причинами:
- Высокое давление в протоках.
- Случайное повреждение желчного пузыря при пункции.
- Повреждение при пункции внепеченочных желчных протоков и 12-перстной кишки.
- Необходимость повторного пунктирования печени.
Поскольку при обтурационной желтухе желчь часто оказывается инфицированной, при истечении желчи в брюшную полость есть высокий риск развития перитонита. Поэтому необходимо своевременное дренирование желчных затеков с назначением антибактериальных препаратов.
Нарушение проходимости стента
Обтурация стента может развиться из-за его смещения, прорастания опухоли внутрь его просвета, а также инкрустрации стента кристаллами желчи. Во всех случаях требуется повторная операция по стентированию желчных протоков.
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Применение саморасправляющихся металлических стентов при опухолях билиопанкреатодуоденальной зоны
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(2): 12‑17
Галлингер Ю.И., Хрусталева М.В., Юсупова Х.И. Применение саморасправляющихся металлических стентов при опухолях билиопанкреатодуоденальной зоны. Хирургия. Журнал им. Н.И. Пирогова. 2010;(2):12‑17.
Gallinger IuI, Khrustaleva MV, Iusupova KhI. The use of self-expanding metal stents by tumors of biliopancreatoduodenal zone. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2010;(2):12‑17. (In Russ.).
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Представлен опыт применения нитиноловых билиарных стентов при нарушениях оттока желчи, вызванных бластоматозным поражением органов билиопанкреатодуоденальной зоны. За период с декабря 2006 г. по июнь 2009 г. нитиноловые стенты были установлены 15 пациентам. Во всех случаях стентирование было успешным. Отдаленные результаты прослежены у всех 15 пациентов. Летальный исход наступил у 8 пациентов в сроки от 5,5 до 11 мес от момента установки нитинолового стента. Установленные билиарные стенты функционировали до конца жизни. Под наблюдением находятся 7 пациентов. В сроки наблюдения от 2,5 до 15 мес нитиноловые стенты у 6 функционируют без признаков окклюзии. В одном случае наблюдался рецидив желтухи, обусловленный окклюзией нитинолового стента через 11 мес после его установки, что потребовало рестентирования. Сделан вывод об эффективности и относительной безопасности применения данного метода в целях восстановления оттока желчи при опухолевой обструкции билиарного тракта.
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Введение
При механической желтухе, возникающей вследствие опухолевой обструкции желчных протоков, наиболее эффективным методом желчеотведения является транспапиллярное стентирование внепеченочных желчных протоков. У неоперабельных больных с распространенным опухолевым процессом или имеющих тяжелые сопутствующие заболевания эндопротезирование служит альтернативой хирургическому лечению и окончательным паллиативным методом декомпрессии билиарного тракта [1, 2, 4]. Эндопротезирование общего желчного протока у пациента с механической желтухой, обусловленной раком поджелудочной железы, впервые выполнил N. Soehendra в 1979 г. [18]. С 80-х годов прошлого века началось широкое применение эндопротезирования желчных протоков с помощью пластиковых стентов. В РНЦХ им. акад. Б.В. Петровского накоплен достаточно большой опыт применения полимерных эндопротезов, безусловными достоинствами которых являются простота конструкции, невысокая стоимость и возможность их замены в случае дисфункции. Недостатком полимерных стентов, актуальным по сегодняшний день, остаются короткие сроки функционирования [1, 3, 4].
С конца 80-х годов прошлого века для клинического использования были предложены саморасправляющиеся металлические стенты (СМС). По данным зарубежных исследований, применение СМС позволило решить проблему длительного и адекватного дренирования при опухолевых стенозах внепеченочных желчных протоков [7, 8, 10]. Главным преимуществом СМС является их большой диаметр (24-30 Fr), сравнимый с диаметром общего желчного протока в норме, что определяет хорошие результаты дренирования. Большинство зарубежных авторов считают, что СМС оптимальны по всем параметрам, не требуют замены и у неоперабельных пациентов с билиарной блокадой могут функционировать в течение всей оставшейся жизни [8, 14, 17].
В России опыт клинического применения металлических саморасправляющихся билиарных стентов практически отсутствует, поэтому мы сочли целесообразным поделиться своими первыми наблюдениями по использованию этой методики.
Материал и методы

Металлические билиарные стенты представляют собой цилиндрические конструкции, сплетенные из стальной или нитиноловой проволоки. Они могут быть непокрытыми или иметь полимерное покрытие в виде пленки на всем протяжении стента. Для введения в зону стеноза стенты упакованы в специальное доставочное устройство, диаметр которого составляет от 7 до 10 Fr. В системе доставки нитиноловый стент находится в сжатом виде и расправляется до заданного диаметра после снятия наружной оболочки (рис. 1). Рисунок 1. Саморасправляющийся нитиноловый стент: частичное высвобождение из доставочного устройства.

В последние годы появилось новое поколение эндопротезов, которые отличаются хорошей расширяющейся способностью, низким коэффициентом укорочения и атравматичной конструкцией концов дренажей. Этим требованиям в полной мере отвечают стенты Shim-hanarostent («M.I.Tech», Южная Корея) и Nitinella («Ella CS», Чехия). Они имеют различный диаметр - от 6 до 10 мм, длину от 22 до 102 мм (рис. 2). Рисунок 2. Покрытые билиарные стенты. а - Shim-hanarostent (Корея); б - Nitinella (Чехия).
В РНЦХ им. акад. Б.В. Петровского за период с декабря 2006 г. по июнь 2009 г. 15 пациентам с опухолями билиопанкреатодуоденальной зоны было установлено 16 нитиноловых стентов. Возраст больных от 39 до 86 лет; мужчин было 7, женщин - 8. Более половины пациентов были старше 60 лет. Причиной механической желтухи у 12 больных была опухоль головки поджелудочной железы, у 2 - опухоль большого сосочка двенадцатиперстной кишки, у 1 - опухоль общего желчного протока.
В данной группе больных уровень билирубина колебался в пределах 28,0-220,5 мкмоль/л. У большинства больных этот показатель превышал 100 мкмоль/л. Длительность желтухи варьировала от нескольких дней до 3 мес и более. Для разрешения желтухи всем пациентам перед установкой нитинолового стента проводилась первичная билиарная декомпрессия. В качестве первичного эндоскопического способа желчеотведения у 6 пациентов было выполнено эндопротезирование полимерными стентами, у 2 - назобилиарное дренирование, у 7 пациентов - назобилиарное дренирование, затем эндопротезирование полимерными стентами.
При комплексном обследовании у 11 пациентов был выявлен распространенный бластоматозный процесс, у остальных 4 больных определен высокий операционный риск, связанный с тяжелыми сопутствующими заболеваниями. Эти критерии имели решающее значение при отказе как от радикального, так и от паллиативного хирургического вмешательства, а также выборе окончательного способа дренирования. Таким образом, целью применения нитиноловых стентов было паллиативное лечение пациентов со злокачественной билиарной обструкцией.

Для восстановления желчеоттока в 10 наблюдениях были использованы стенты Shim-hanarostent с полиуретановым покрытием, в 6 - стенты Nitinella, из которых 3 стента были с покрытием, 3 - без покрытия. Протяженность опухолевого стеноза составляла от 1,5 до 5 см, диаметр стентов варьировал от 6 до 10 мм, длина - от 52 до 100 мм. Длину нитинолового стента подбирали на основании данных холангиографии, ориентируясь на расстояние от проксимального края сужения до устья общего желчного протока, прибавляя к полученной длине 2-3 см. Устанавливали саморасправляющиеся металлические стенты по каналу дуоденоскопа. По струне-проводнику в просвет протока выше зоны стеноза проводили доставочное устройство со сложенным внутри стентом. Под рентгенологическим и эндоскопическим контролем стент располагали на уровне сужения и затем высвобождали путем снятия наружной оболочки. Особенностью установки саморасправляющихся стентов является необходимость очень медленного освобождения их от наружной оболочки с одновременной надежной фиксацией доставочного устройства в неподвижном положении. Это обеспечивает адекватное раскрытие стента и препятствует его смещению. После полного расправления стента в желчном протоке в двенадцатиперстной кишке оставались свободные концы эндопротеза протяженностью 1-1,5 см (рис. 3). Рисунок 3. Установленный нитиноловый билиарный стент выступает в двенадцатиперстную кишку.
Результаты и обсуждение
Попытка стентирования во всех 16 наблюдениях была успешной. В одном наблюдении из-за неполного расправления стента возникли трудности при извлечении внутренней части устройства доставки с оливой на конце. Через несколько минут, в течение которых стент постепенно расправился, олива была беспрепятственно извлечена. При контрольном рентгенологическом и эндоскопическом осмотре у большинства пациентов СМС полностью расправились в зоне сужения сразу после установки. В 6 наблюдениях полное расправление стента произошло в течение 1-2 сут. В 15 наблюдениях стенты сразу были установлены в адекватную позицию. В одном наблюдении при рентгенологическом исследовании на 2-е сутки после введения эндопротеза было выявлено, что его проксимальный конец расположен в области левого печеночного протока с перекрытием правого печеночного протока. В данном наблюдении использовали покрытый стент со специальной петлей из полимерной нити на дистальном конце, которая позволила осуществить коррекцию уже полностью раскрытого стента.
При недостаточном расправлении стента может произойти его ранняя дисфункция, при этом СМС могут мигрировать [7, 11, 14]. Мы не наблюдали смещений и миграций стентов в ранние сроки после установки. Такие ранние осложнения, как кровотечение, панкреатит, холангит, перфорация, холецистит, развиваются в 10-15% наблюдений [9, 12, 17] и чаще связаны с манипуляциями, предшествующими стентированию, - ЭРХПГ, ЭПСТ. У одного пациента на 2-е сутки после стентирования появилась клиническая картина острого панкреатита, которая купировалась на фоне консервативной терапии. Также в ранние сроки после стентирования (3-7 дней) у 3 больных мы наблюдали клинические симптомы острого холецистита, которые у 2 из них были купированы консервативно. В одном наблюдении после установки покрытого нитинолового стента возник острый холецистит, связанный, вероятно, с перекрытием стентом устья пузырного протока. После безуспешной консервативной терапии, на 9-е сутки после билиарного стентирования была выполнена холецистэктомия.
В наших наблюдениях в позднем периоде у 3 больных с установленными нитиноловыми билиарными стентами распространение опухолевого процесса привело к стенозу двенадцатиперстной кишки. В одном наблюдении в результате разрастания опухоли большого сосочка двенадцатиперстной кишки возник стеноз последней уже через 2 мес после транспапиллярного стентирования. В другом наблюдении через 6 мес после эндопротезирования желчного протока наблюдалось стенозирование двенадцатиперстной кишки, обусловленное прорастанием опухоли головки поджелудочной железы. В обоих наблюдениях было выполнено эндопротезирование кишки непокрытыми нитиноловыми пилородуоденальными стентами. На момент протезирования у обоих пациентов отмечалось адекватное расположение и функционирование билиарных нитиноловых стентов, установленных ранее. Летальный исход, связанный с прогрессированием основного заболевания, констатирован в первом наблюдении через 6 мес, во втором - через 9 мес после установки билиарного нитинолового стента при отсутствии признаков его окклюзии и рецидива желтухи и без нарушения эвакуации из желудка.
У третьей больной с опухолью головки поджелудочной железы стеноз двенадцатиперстной кишки был выявлен через 11 мес после транспапиллярного стентирования, он сопровождался рецидивом желтухи и холангита, что потребовало повторного эндоскопического вмешательства и рестентирования желчных протоков, а также стентирования двенадцатиперстной кишки. Приводим это наблюдение.
Пациентка Д., 73 лет, поступила в РНЦХ 22.02.08 с диагнозом опухоль головки поджелудочной железы. Механическая желтуха. Сопутствующие заболевания: хронический холецистит, гипертоническая болезнь II стадии, стенокардия напряжения 2 ФК. За месяц до госпитализации больная с явлениями желтухи находилась в инфекционном отделении городской больницы по месту жительства. Затем была переведена в хирургическое отделение, где при компьютерной томографии органов брюшной полости выявлена картина билиарной гипертензии, обусловленной блоком терминального отдела общего желчного протока. 29.01 была выполнена операция: эксплоративная лапаротомия, дренирование общего желчного протока по Вишневскому. Интраоперационно верифицирована опухоль головки поджелудочной железы с вовлечением стенки двенадцатиперстной кишки. В послеоперационном периоде проводилась консервативная терапия. Больная выписана в удовлетворительном состоянии и направлена в РНЦХ для эндопротезирования желчных протоков.
22.02.08 произведена ЭРХПГ, при которой выявлен блок средней трети печеночных протоков. Во внепеченочные желчные протоки установлен тефлоновый стент диаметром 8,5 Fr, длиной 10 см. Отмечен сброс по протезу чистой желчи, по стенту выполнено рассечение большого сосочка двенадцатиперстной кишки. Желтуха купирована в течение недели.
Больной проведено комплексное обследование. С учетом распространенности процесса, общего состояния и предполагаемой продолжительности жизни возникла необходимость в обеспечении длительного и адекватного дренирования. С этой целью 03.03 (после разрешения желтухи) выполнена смена полимерного дренажа на покрытый нитиноловый стент Shim-hanarostent диаметром 8 мм и длиной 8 см. В послеоперационном периоде возникла клиническая картина острого холецистита. После безуспешной консервативной терапии 12.03 выполнена холецистэктомия. Послеоперационный период протекал без осложнений, и 25.03 больная в удовлетворительном состоянии выписана под амбулаторное наблюдение.
В течение следующих 10 мес пациентка пребывала в удовлетворительном состоянии, но в феврале 2009 г. появилась клиническая картина желтухи и холангита.
05.02.09 произведена дуоденоскопия, при которой выявлен стеноз бульбодуоденального перехода за счет инвазии опухоли в двенадцатиперстную кишку. После баллонной дилатации зоны стеноза удалось провести эндоскоп в нижележащие отделы и осмотреть эндопротез, установленный ранее. Нитиноловый стент выступал из устья общего желчного протока в просвет кишки на 2,5 см, что свидетельствовало о его некотором смещении в дистальном направлении. При осмотре просвет стента полностью обтурирован билиарным сладжем, полимерное покрытие на участке, выступающем в просвет кишки, разрушено. Попытки провести катетер со струной через просвет протеза или параллельно ему оказались безуспешными. Принято решение об удалении нитинолового стента. Стент захвачен эндоскопической петлей и без каких-либо технических трудностей низведен из общего желчного протока, а затем извлечен наружу. После удаления стента отмечено поступление из просвета протока густой вязкой желчи с примесью гноя и сладжа. При контрастировании определяется стеноз протяженностью до 4 см. Вмешательство завершено назобилиарным дренированием с целью временной декомпрессии и санации желчных протоков.

При осмотре извлеченного нитинолового стента отмечено следующее: просвет его полностью обтурирован сладжем, при вымывании сладжа в средней трети стента обнаружен конкремент овальной формы размером 8×6 мм, практически полностью перекрывающий просвет стента. Металлический каркас не изменен, форма и гибкость стента сохранены. Полиуретановое покрытие нижней трети стента (участок, выступавший в просвет кишки) разрушено, на остальной его части сохранено (рис. 4). Рисунок 4. Удаленный нитиноловый стент. а - просвет полностью обтурирован билиарным сладжем; б - полимерное покрытие на участке, выстоявшем в просвет кишки, разрушено.
10.02 после предварительной баллонной дилатации стеноза двенадцатиперстной кишки выполнено рестентирование желчных протоков. Покрытый стент Nitinella диаметром 8 мм и длиной 5 см установлен в адекватной позиции, отмечен сброс желчи по его просвету. При обзорной рентгенографии 12.02 выявлено, что эндопротез установлен в область левого печеночного протока с перекрытием правого. После повторной баллонной дилатации стеноза двенадцатиперстной кишки выполнена дуоденоскопия с коррекцией положения нитинолового стента. 19.02 после баллонной дилатации стеноза в двенадцатиперстную кишку установлен непокрытый нитиноловый пилородуоденальный стент («M.I.Tech», Корея) диаметром 22 мм и длиной 8 см.

20.02 при обзорной рентгенографии определяются нитиноловые стенты в общем желчном протоке и в двенадцатиперстной кишке, которые расположены в адекватной позиции и функционируют (рис. 5). Рисунок 5. Обзорная рентгенограмма. а - билиарный и пилородуоденальный нитиноловые стенты расположены в адекватной позиции; б - стенты полностью раскрыты.
Больной проводилась консервативная антибактериальная, обезболивающая, гемостатическая, инфузионная терапия, на фоне которой желтуха купирована, снизился лейкоцитоз, снят болевой синдром. 25.02 больная в удовлетворительном состоянии выписана из клиники. При контрольном обследовании через месяц положение установленных стентов адекватное, пилородуоденальный отдел кишки проходим, нарушений желчеоттока нет.
Таким образом, транспапиллярное эндопротезирование саморасправляющимися металлическими протезами является малотравматичным, довольно безопасным и эффективным методом билиарной декомпрессии при механической желтухе бластоматозной природы. Во всех наблюдениях попытка стентирования была успешной и сопровождалась небольшим числом осложнений. В случае дисфункции покрытых нитиловых стентов даже в отдаленном периоде оказалось возможным их извлечение и выполнение рестентирования. Применение саморасправляющихся металлических стентов обеспечивает надежное и длительное дренирование желчных протоков и может быть рекомендовано в качестве основного метода паллиативного лечения при неоперабельных опухолях билиопанкреатодуоденальной зоны. В случае, если распространение опухолевого процесса приводит к стенозу двенадцатиперстной кишки, возможна его коррекция с помощью нитиноловых пилородуоденальных стентов.

Хирургическое вмешательство – самый эффективный метод лечения рака поджелудочной железы. В клинике НАКФФ операции проводятся безопасно, с низким риском осложнений, низкой летальностью пациентов. Используются не только открытые, но и лапароскопические вмешательства. Наши хирурги проводят как радикальные, так и паллиативные операции.
Какие операции проводятся при раке поджелудочной железы
Операции при раке поджелудочной железы можно разделить на две группы:
В ходе радикальной операции врач удаляет опухоль, окружающие её ткани и лимфоузлы.
Паллиативные вмешательства обычно более щадящие. Полное удаление опухоли не требуется, лимфодиссекция не проводится. Целью операции является улучшение качества жизни пациента. Обычно хирургическое вмешательство направлено на устранение желтухи, боли в животе или кишечной непроходимости.
Варианты радикальных вмешательств:
- Панкреатодуоденальная резекция.
- Дистальная панкреатоспленэктомия.
- Секторальная резекция.
- Субтотальная панкреатэктомия.
- Тотальная панкреатэктомия.
- Пилоросохраняющая панкреатодуоденальная резекция.
Операция Уиппла
Чаще всего для лечения рака проводится панкреатодуоденальная резекция. В ходе операции врач удаляет головку поджелудочной железы, 12-перстную кишку, большой сальник, желчный пузырь, часть холедоха и часть желудка. Удаляются также лимфатические узлы.
После резекции органов, пораженных опухолью, проводится реконструктивный этап операции. Врач восстанавливает целостность желудочно-кишечного тракта, а также формирует анастомозы для нормального оттока желчи и панкреатического сока в тонкий кишечник.

Главный врач, онколог-хирург
Доктор медицинских наук
Опыт работы: Более 30 лет
Операция Уиппла – технически сложная, а результаты во многом зависят от опыта и квалификации хирурга. Риск серьезных осложнений после хирургического вмешательства достигает 15%. На восстановление требуется несколько месяцев.
В последние годы удаление злокачественной опухоли поджелудочной железы всё чаще выполняется лапароскопическим методом. Исследования показали, что если операция проводится опытным хирургом, то она позволяет получить аналогичные показатели выживаемости пациентов по сравнению с открытым вмешательством. При этом лапароскопия менее травматичная. Пациенты после неё восстанавливаются быстрее.
Другие радикальные операции
Другие типы хирургических вмешательств применяются реже.
Дистальная панкреатоспленэктомия проводится, если опухоль появляется в хвосте поджелудочной железы. Врач удаляет эту часть органа, а также селезенку. Эти операции применяются редко. Во-первых, в хвосте поджелудочной железы рак развивается реже. Во-вторых, он обнаруживается позже, так как не вызывает желтухи. В итоге новообразования выявляются на поздней стадии, когда радикальное хирургическое вмешательство невозможно.
Тотальная панкреатэктомия предполагает удаление всей поджелудочной железы. После такой операции пациент вынужден пожизненно получать заместительную терапию инсулином и ферментами поджелудочной железы. Хирургическое вмешательство используется, только если опухоль не выходит за пределы поджелудочной железы, при этом поражает разные отделы органа и не прорастает в крупные сосуды.
Читайте также:

