3 правила забора материала на серологическое исследование
Обновлено: 05.05.2024
Для предотвращения гемолиза сыворотку следует отделить от сгустка. Сгусток сохраняется в пробирке только при первом заборе и используется для вирусологического и молекулярно-генетического исследований.
Кровь должна быть доставлена в вирусологическую лабораторию в течение первых 24 ч. с момента взятия в термосе или сумке-холодильнике с холодовыми элементами. Транспортируют кровь при температуре от 0 до 8 град. С.
Цельную кровь нельзя замораживать, так как это ведет к полному гемолизу. Кровь становится непригодной для серологических исследований и приобретает токсические свойства для лабораторных животных и тканевых культур.
Добавление консервантов и инактивация материала для вирусологического исследования недопустима.
Сопроводительный документ (направление) тщательно упаковывают в полиэтиленовый пакет и прикрепляют к емкости с клиническим материалом.
Правила отбора и транспортирования материала от больных и подозрительных на заражение людей для исследования на лихорадку Западного Нила
1. Для предохранения от инфицирования медицинского персонала и пациентов при сборе проб биоматериалов и доставке его в лабораторию необходимо:
- не загрязнять наружную поверхность посуды при сборе и доставке проб;
- не загрязнять сопроводительные документы (направления);
- свести к минимуму непосредственный контакт пробы биоматериала с руками медицинского работника, собирающего и доставляющего его в лабораторию;
- соблюдать асептические условия для предотвращения инфицирования пациента в процессе выполнения инвазивных мероприятий;
- собирать пробы в стерильную одноразовую посуду;
- транспортировать пробы в переносках или укладках с раздельными гнездами.
2. Для серологического исследования необходимо двукратное взятие крови. Первую пробу берут при первых признаках болезни, при подозрении на ЛЗН, вторую - через 10-14 дней после первого забора крови. Кровь забирают в асептических условиях из вены в количестве 5-8 мл в стерильную пробирку и закрывают стерильной пробкой.
3. Для вирусологического исследования берут кровь не позднее 5-го дня болезни, в стадии вирусемии.
4. Кровь должна быть доставлена в вирусологическую лабораторию в течение первых 24 ч. с момента взятия в термосе или сумке-холодильнике с холодовыми элементами. Транспортируют кровь при температуре от 0 до 8 град. С.
Цельную кровь нельзя замораживать, так как это ведет к полному гемолизу. Кровь становится непригодной для серологических исследований и приобретает токсические свойства для лабораторных животных и тканевых культур.
Сопроводительный документ (направление) тщательно упаковывают в полиэтиленовый пакет и прикрепляют к емкости с клиническим материалом.
5. Обработка проб крови для серологического анализа в лаборатории. Кровь центрифугируют в течение 10-15 мин. при 2500 об./мин., сыворотку отделяют от осадка и используют для серологических исследований.
6. При посмертной диагностике берут кусочки мозга (из разных отделов), печени и селезенки. Взятый материал помещают в стерильные флаконы с пробками, которые помещают в полиэтиленовые пакеты, завязывают и опускают в термос со льдом.
7. Если материал для выделения вируса может быть доставлен в лабораторию в течение 2-4 ч., то достаточно поместить его в термос со льдом при температуре от 0 до 8 град. С. В лаборатории кусочки тщательно измельчают и готовят 10%-ю суспензию в растворе Хенкса (или в фосфатно-буферном растворе, или питательной среде), поддерживая температуру обрабатываемого материала на уровне 5 град. С. Суспензию центрифугируют в течение 15 мин. при 2500 об./мин. Прибавляют к надосадочной жидкости пенициллин и стрептомицин по 100-200 ЕД/мл и используют ее для заражения белых мышей или клеточных культур.
Если доставка материала требует нескольких дней, то его транспортируют в термосах с азотом или сухим льдом. В этом случае до замораживания нужно отделить сыворотку крови от сгустка.
8. Для проведения ОТ-ПЦР забор плазмы крови и спинномозговой жидкости проводят не позднее 12 дня от начала заболевания. Материал для обследования методом ПЦР (плазма и/или сыворотка крови, СМЖ, образцы других тканей, моча) должен забираться с использованием только одноразовых пробирок и медицинского инструментария с соблюдением правил асептики и храниться при температуре - 70 град. С или в жидком азоте, не допуская его оттаивания до проведения исследования.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
токсины микроорганизмов и специальные диагностики, в которых содержатся токсины известных микроорганизмов или известные иммуноглобулины.
Серологические методы лабораторной диагностики были предложены в 1886 году французом Видалем для диагностики брюшного тифа (РА). Реакция была основана на обнаружении специфических О и Н антител в сыворотке крови больного брюшным тифом.
При длительно текущих болезнях для более достоверного получения данных применяют метод «парных сывороток», то есть одну и туже реакцию проводят дважды и сравнивают полученные результаты.
В настоящий момент применяют более чувствительные методы серологического исследования, позволяющие обнаружить в крови антител в 10 раз меньше содержания. Эти реакции дают положительный результат в 82%.
Важнейшее место в диагностике занимает иммунно-флюоресцентный метод (ИФ).
Этот метод позволяет выявить возбудителя в исследуемом материале без выделения его в питательной культуре, но, к сожалению, он применяется редко, т.к. дорогостоящ и сложен по проведению.
С помощью серологических реакций идентифицируются микроорганизмы, токсины, а природу антитела в крови больного определяют с помощью известного диагностического антигена.
Основными серологическими реакциями являются:
1. Реакция агглютинации;
2. Реакция преципитации;
3. Реакция связывания комплемента;
4. Реакция иммуно-флооресценции;
5. Реакции лизиса;
6. Реакция нейтрализации вирусов на культуре клеток;
7. Реакция торможения гемоагглютинации;
8. Реакция иммуноферментативного анализа;
9. Реакция иммуноблотинга.
Общие закономерности серологических реакций:
1. Реакции ставят вне организма человека
2. Реакции проявляются при иммунологическом соответствии антигена и антитело в соответствующих оптимальных условиях температуры и кислотности среды.
Иммунные диагностические сыворотки получают от крупных животных, путем многократного заражения или введения токсинов.
К диагностическим сывороткам относятся:
1. Агглютинирующие бактерии;
2. Прецепитирующие бактерии;
3. Гемолизирующие бактерии;
4. Антивирусные сыворотки;
5. Антитоксические сыворотки;
6. Люминесцентные сыворотки;
7. Флюорохромные сыворотки;
К диагностическим антигенам относятся взвеси живых и убитых микроорганизмов и их токсины.
Е.Б. Лукоянычева–заведующая иммунологической лабораторией ГУЗ КОКБ.
Правила забора биологического материала для иммунологических исследований: Методические рекомендации / Авт.-составитель О.М.Луппова.- Кемерово: ГУЗ КОКБ ,2008.-25 стр.
© ГУЗ «Кемеровская областная клиническая больница», 2008г
Введение 4
Раздел 1. Общие правила забора биологического материала и оформления сопроводительных документов
Раздел 2.Технология забора крови из периферической вены для лабораторного исследования
Раздел 3.Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
Раздел 4.
Транспортировка образцов крови
Раздел 5.
Требование к маркировке пробирок
Раздел 6
Образец оформления пробирок и заполнения сопроводительных документов
Приложение № 1
Забор крови на иммунограмму
Приложение №2.
Забор крови на циркулирующий иммунный комплекс
Приложение №.3
Забор крови на криоглобулины
Приложение №.4
Забор крови на группу крови и резус принадлежность
Приложение №5.
Забор крови на реакцию Кумбса
Приложение №6
Забор крови на гемоконтактные гепатиты В и С (HBsAg, анти – HCV)
Приложение №7.
Забор крови на развернутый комплекс маркеров гепатитов
Приложение №8.
Забор крови на клещевой энцефалит, боррелиоз
Приложение №9.
Забор крови на антитела к антигенам описторхисов, лямблий, хеликобактеру
Приложение №10.
Забор крови на цитомегаловирус, токсоплазмоз, герпес
Приложение №.11
Забор крови на а/т к тироидной пероксидазе
Приложение №12
Забор крови на ВИЧ 23
Приложение № 4(образец заполнения)
Список литературы
Данное методическое пособие предназначено для медицинских сестер Кемеровской областной клинической больницы.
Методическое пособие поможет правильно произвести забор биологического материала и оформить сопроводительные документы.
Правильно произведенный забор биологического материала и правильно оформленные направления исключат ошибку на преаналитическом этапе исследования.
Формы сопроводительных документов составлены так, чтобы сократить время медицинской сестры, затрачиваемое на оформление направлений.
Необходимо, чтобы образцы крови были правильно взяты и вовремя доставлены в лабораторию. Нарушения, допущенные на преаналитическом этапе, могут повлиять на результат исследования и его дальнейшую интерпретацию.
Раздел 1.
Общие правила забора биологического материала и оформления сопроводительных документов
Перед забором крови пациенту следует сообщить:
1. На какой вид исследования будет проводиться забор крови.
2. Требования необходимые для данного исследования.
Порядок забора венозной крови
1. Исследование проводится утром натощак, последний прием пищи за 12 часов до взятия крови.
2. Исключение приема алкоголя не менее чем за 24 часа до взятия крови.
3. Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
5. Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
6. Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
7. Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
Раздел 2
Технология забора крови из периферической вены для лабораторного исследования
подготовить на манипуляционном столе стандартный набор для забора крови из периферической вены, проверив целостность упаковок и сроки годности:
1. лоток для использованных материалов;
2. пробирки для крови;
3. упаковка с 2-мя стерильными салфетками (5х5см) или 4-5 шариками;
5. кожный спиртовой антисептик во флаконе с дозатором;
сделать необходимые надписи на пробирках;
оформить сопроводительные документы в лабораторию;
обеспечить удобное освещение;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
обработать руки спиртовым антисептиком;
вскрыть упаковки со стерильными материалами;
руку больного уложить в положении максимального разгибания, для чего под руку следует положить валик, имеющий влагостойкое покрытие.
наложить жгут на 10 - 15 см выше выбранной зоны, не нарушая ток крови;
выбрать вену для венепункции;
обработать место венепункции кожным антисептиком и дать высохнуть самостоятельно;
Не пальпируйте вену повторно!
надеть на стерильный шприц иглу;
снять с иглы защитный колпачок;
пальцами левой руки фиксировать кожу над веной;
ввести под кожу иглу срезом вверх под углом 30-40 0 ;
установить иглу параллельно вене и быстрым движением проколоть ее стенку;
иглу продвинуть немного вверх по длине вены;
набрать необходимое количество крови в шприц
- запрещается забор крови свободным кровотоком из иглы в пробирку, а также присоединение к игле нового шприца;
- для безопасного забора крови предпочтительно использовать вакуумный шприц-контейнер.
иглу извлечь из вены;
прижать место венепункции стерильной салфеткой на 2-3 минуты;
осторожно, предупреждая разбрызгивание крови, вылить содержимое шприца через иглу в одну или несколько пробирок.
набрать из емкости «Для дезинфекции инструментов» дезинфицирующий раствор через иглу в шприц;
вставить иглу в специальное отверстие контейнера «Для дезинфекции режущего и колющего инструментария» и, повернув ее, отделить от шприца и оставить в нем в растворе дезинфектанта;
Раздел 3
Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
Закрытые системы взятия венозной крови представляют собой новое поколение вакуумных шприцев - контейнеров с реактивами. Их использование имеет следующие преимущества перед традиционными способами:
полностью исключается контакт медперсонала с кровью на всех этапах взятия крови и ее транспортировки;
особо прочный пластик закрытых систем позволяет осуществить безопасную доставку крови на любые расстояния;
благодаря наличию широкого спектра пробирок с заранее добавленными реагентами для различных видов анализов (ЭДТА для гематологии, цитрат натрия для коагулогии, активатор свертывания для получения сыворотки), значительно облегчается работа медсестер и лаборатории. Международная цветовая маркировка предотвращает их не правильное применение;
уменьшается количество ошибочных анализов, связанных с неправильным взятием проб крови и неверным соотношением реагентов.
закручивающаяся крышка предотвращает "аэрозольный эффект" при открывании;
1. Надеть иглу на контейнер и закрепить легким поворотом по часовой стрелке. Провести пункцию вены.
1. Провести пункцию вены иглой. Благодаря защитной мембране кровь из иглы не вытекает.
2. Медленно оттягивая поршень, наполнить контейнер кровью. После заполнения кровью контейнер вместе с иглой вынуть из вены. Поршень зафиксировать в конечном положении до характерного щелчка. В случае взятия нескольких образцов крови, контейнер отсоединить. Иглу оставить в вене и на нее надеть следующий контейнер.
2. Создать вакуум в контейнере.
Для этого отвести поршень в конечное положение (до характерного щелчка) и отломить его
3. По окончании взятия крови, шток поршня обломить. Вы получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
3. Насадить контейнер на иглу. Взятие крови осуществляется под действием вакуума. В этом случае вы также получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
Транспортировка образцов крови
При транспортировке образца внутри лечебно-диагностического учреждения, пробирки с кровью должны находиться в контейнере, который в случае повреждения пробирки будет предотвращать разлитие крови.
Порядок доставки крови в лаборатории
- Штативы с кровью поместить в герметичный контейнер;
наружные части контейнера двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму для вирусных гепатитов);
доставить контейнер в лабораторию;
вынимать образцы крови из контейнера только в перчатках!
после возвращения из лаборатории контейнер вновь двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму, предусмотренному для гемоконтактных вирусных гепатитов).
Требование к маркировке пробирок.
Маркировку пробирок и заполнение сопроводительных документов следует проводить аккуратно и четко.
Фамилию, имя, отчество пациента писать четко и разборчиво.
В направлении заполнять все графы.
Не допускается, чтобы этикетка на пробирке была размыта, порвана или плохо приклеена.
Общим правилом для пациентов, подвергающихся забору крови, должно быть воздержание от физических нагрузок, приема алкоголя, лекарственных препаратов, изменений в питании хотя бы в течение 24 ч до взятия крови, приема пищи в течение 10-12 ч и курения в течение 3 ч. Если пациент принимает лекарственные препараты, которые нельзя отменить, но они могут повлиять на исследование, об этом необходимо сообщать в лабораторию.
Анализ начинается с заявки на исследование: Ф.И.О. пациента, возраст, пол, отделение, предположительный диагноз, дата и время забора крови, перечень необходимых исследований. Ф.И.О. лечащего врача, подпись взявшего материал для анализа.
Лучшим местом взятия крови на анализы является локтевая вена.
Перед выполнением венепункции процедурная медсестра должна убедиться в том, что пациент правильно подготовлен к исследованию, и удостовериться, что это именно тот пациент, которому необходимо брать кровь.
Если в вене стоит катетер, то можно брать кровь из него, проследив, чтобы кровь не была разбавлена вливаемыми пациенту растворами. При взятии крови из катетера первые 10-12 капель удаляются (не используются для анализа).
Частой причиной ошибок является гемолиз пробы. К этому приводит как длительное взятие крови у тяжелобольных пациентов с низким артериальным давлением и у пациентов со склерозированными венами, так и слишком быстрое взятие крови, тонкие иглы, сильное давление на поршень шприца при переливании крови в пробирку, влажные пробирки, неправильное приготовление антикоагулянта.
Нельзя использовать пластиковые пробирки многократно, а также плохо вымытые стеклянные пробирки, что особенно сказывается на определении железа, кальция. При мытье пробирок не следует использовать воду плохого качества (примесь аммиака, хлора).
Забор крови проводится:
для бактериологического исследования — в стерильный флакон со специальной средой;
серологического исследования - в количестве 3-5 мл в сухую пробирку;
биохимического исследования — в количестве 5—15 мл в сухую центрифужную пробирку;
исследования крови на ВИЧ - в количестве 5 мл в пробирку.
Забор крови из вены для биохимического исследования, для исследования на rw,
ВИЧ-ИНФЕКЦИЮ
Противопоказания: поражение кожи и подкожно-жировой клетчатки любого характера в предполагаемом месте инъекции, флебит пунктируемой вены.
Место пункции: поверхностные вены локтевого сгиба, предплечья, тыльной поверхности кисти, стопы.
Оснащение: см. «Приготовление рабочего места и рук для работы со шприцами», «Сборка стерильного шприца одноразового использования»; фантом для внутривенной инъекции, штатив с пробирками, бланки направлений, прорезиненная подушечка, венозный жгут, защитные очки (экран), нарукавники, маска, фартук, контейнер для транспортировки пробирок.
Последовательность выполнения.
1. Подготовить рабочее место (см. «Приготовление рабочего места и рук для работы со шприцами»). Надеть фартук, нарукавники (при кротких рукавах медицинского халата). На верхнюю полку манипуляционного стола выложить стерильный одноразовый шприц, штатив с пробирками, стерильные ватные шарики в двойной упаковке. Проверить время, дату стерилизации и состояние наружного индикатора на упаковке со стерильными ватными шариками, вскрыть упаковку и оценить состояние внутреннего индикатора.
Пригласить пациента, предложить ему сесть (лечь), объяснить ход процедуры, установить доверительные отношения. Подготовить пациента психологически.
Собрать шприц (см. «Сборка стерильного шприца одноразового использования»).
Надеть очки, маску.
Освободить предполагаемое место инъекции от одежды, осмотреть и обследовать его пальпаторно.
Под локоть пациента положить прорезиненную подушечку.
Наложить венозный жгут (на рубашку или салфетку) на 10—12 см выше места инъекции. Завязать жгут так, чтобы его свободные концы были направлены вверх, а петля — вниз. Проверить пульс на лучевой артерии (пульс должен быть!).
Попросить пациента несколько раз сжать и разжать кулак.
Обработать руки в перчатках дезинфектантом для рук.
Взять рукой три стерильных ватных шарика и смочить их антисептиком.
Обработать место инъекции: первым шариком — широко, вторым — узко, одновременно проверяя наполнение вен. Использованные шарики сбросить в емкость для дезинфекции. Подождать, пока подсохнет место инъекции и подействует антисептик (40секунд).
Взять шприц в правую руку, снять колпачок с иглы шприца, сбросить его в лоток для отработанного материала, проверить еще раз отсутствие воздуха в шприце.
Указательный палец положить сверху (или сбоку) на канюлю иглы, остальными охватить цилиндр сверху. Попросить пациента сжать кулак.
Большим пальцем левой руки натянуть кожу в области инъекции и фиксировать вену.
Не меняя положения правой руки на шприце, держа иглу срезом вверх (почти параллельно коже), проколоть кожу и расположить иглу параллельно вене.
Продолжая фиксировать вену, слегка изменить направление иглы, осторожно пунктировать вену и продвинуть иглу по ходу вены на 1/3 ее длины. Должно возникнуть ощущение попадания «в пустоту».
Потянуть поршень на себя левой рукой (положение правой руки на шприце не менять!). Появление в шприце крови свидетельствует о том, что игла находится в вене.
Набрать в шприц 5-15 мл крови.
Попросить пациента разжать кулак. Развязать жгут левой рукой.
Прижать к месту инъекции третий шарик, смоченный антисептиком, извлечь иглу.
При пункции вен локтевого сгиба попросить пациента согнуть руку в локтевом суставе на 3-5 минут или наложить давящую повязку на место пункции (шарик сбросить в емкость для дезинфекции).
Левой рукой открыть пробирку, стоящую в штативе, зажать пробку мизинцем. Медленно выпустить кровь по внутренней стенке пробирки.
Закрыть пробирку пробкой и поставить в штатив.
Поинтересоваться самочувствием пациента.
Провести дезинфекцию инструментария.
Обработать ветошью, смоченной дезинфектантом, фартук (при необходимости кушетку), ветошь сбросить в емкость для дезинфекции. Снять фартук, нарукавники, очки.
Взять ветошь, смочить ее раствором дезинфектанта и обработать жгут, сбросить ветошь в емкость для дезинфекции. Второй ветошью, смоченной дезинфектантом, обработать прорезиненную подушечку, сбросить ветошь в емкость для дезинфекции. Промыть жгут и прорезиненную подушечку под проточной водой до исчезновения запаха дезинфектанта. Затем просушить сухой ветошью, ветошь сбросить в емкость для дезинфекции.
Снять медицинский халат.
Снять перчатки, маску и продезинфицировать их в соответствующих емкостях.
Руки вымыть и осушить.
Сделать отметку о выполнении манипуляции в журнале формы ф– 029/у.
Оформить на специальном бланке направление в лабораторию на биохимическое исследование, где указать цель исследования. Ф.И.О. пациента, возраст, отделение, номер палаты, диагноз, номер истории болезни, дату взятия крови и поставить подпись медсестры. Код пациента в направлении и код на пробирке должны совпадать. Транспортировать в специальном контейнере.
При заборе крови на ВИЧ-инфекцию поступающий в лабораторию материал должен сопровождаться направлением в двух экземплярах. Бланки направлений помешают в полиэтиленовый пакет и привязывают к контейнеру. Взятые пробы в отделении регистрируют в журнале учета взятия крови на ВИЧ (дата забора, код пациента, Ф.И.О. пациента, пол, возраст, код контингента, адрес места жительства, диагноз, результат, повторный результат). В медицинской карте ставится штамп «кровь на ВИЧ взята» с указанием даты забора материала и фамилии медсестры, взявшей материал у пациента. Позже фиксируется результат анализа.
При заборе крови на RW необходимо указать цель исследования, Ф.И.О. пациента, возраст, адрес места жительства, отделение, номер палаты, дату взятия крови, поставить подпись медсестры. Код пациента в направлении и код на пробирке должны совпадать. Транспортировать кровь следует в специальном контейнере.
В документированной процедуре изложены правила сбора и транспортирования биологических материалов в лабораторию клинической микробиологии (бактериологии) ГОБУЗ “Мурманская областная клиническая больница им. П. А. Баяндина” в целях повышения качества результатов лабораторных исследований и организации противоэпидемических и профилактических мероприятий, а также профилактики внутрибольничных инфекций у медицинского персонала и пациентов.
Документированная процедура предназначены для использования в МОКБ, а также может использоваться организациями, направляющими заказ на услугу по лабораторной диагностике.
Общие положения
Предложенная техника сбора и транспортирования биологических материалов в ЛКМ МОКБ позволит снизить уровень преаналитической ошибки и повысить качество работы лаборатории по объективизации результатов.
Документированная процедура определяет правила предохранения медицинского персонала и пациентов от инфицирования при сборе и доставке в лаборатории проб биоматериалов, которые могут быть обсеменены бактериями, грибами, вирусами, паразитами.
Общие требования к сбору проб биоматериала для микробиологического исследования
Материал для исследования собирают в достаточном количестве.
Материал должен соответствовать характеру инфекционного процесса.
При сборе материала необходимо использовать только стерильные инструменты и посуду, соблюдая правила асептики для исключения контаминации (загрязнения) биопробы нормальной микрофлорой, т.к. ее наличие приводит к ошибочной трактовке результатов.
При сборе биоматериала медперсонал обязан использовать средства индивидуальной защиты (далее - СИЗ) (перчатки, маска, шапочка, очки и др.).
Необходимо осуществлять сбор биоматериала только в рекомендуемые транспортные среды и контейнеры.
Материал для исследования, по возможности, собирают до начала антибактериальной терапии. При отсутствии такой возможности собирают, непосредственно, перед повторным введением (приемом) препаратов.
В бланке направления на исследование в обязательном порядке указывают наименование принимаемых антибактериальных препаратов.
Не допускается загрязнение наружную поверхность посуды при сборе и доставке проб.
Не допускается загрязнение сопроводительных документов (направлений).
При сборе биоматериала в пробирки, необходимо использовать штативы.
После взятия биоматериала, необходимо сделать запись о процедуре в бланке направления: дату, время взятия, другую информацию.
Правила маркировки проб биоматериала для микробиологического исследования
Все биопробы, поступающие в лабораторию должны пройти процедуру штрих-кодирования.
Наклейки, с нанесенными штрих-кодами, получают в централизованной многофункциональной лаборатории (далее ЦМЛ) МОКБ.
Цель штрих-кодирования - идентификация пациента (на пробирке (контейнере, флаконе) и на бланке должен быть одинаковый номер штрих-кода).
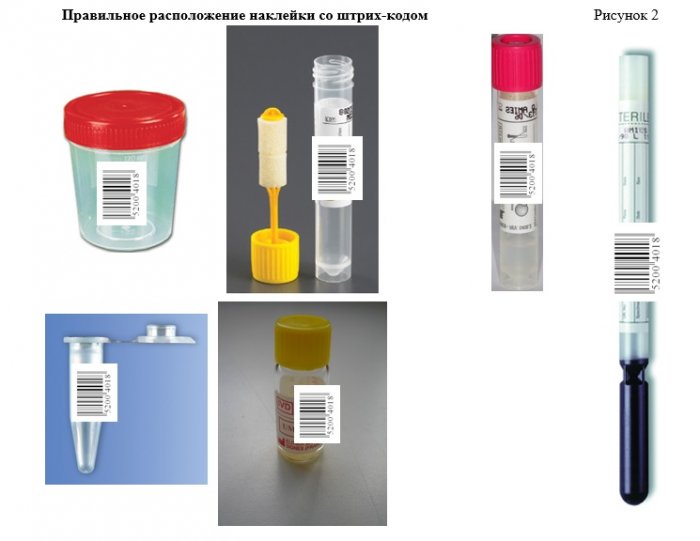
Штрих-код наклеивают на пробирку (контейнер, флакон) строго вертикально цифровой надписью сверху вниз, на имеющуюся наклейку. Необходимо оставить прозрачную зону для контроля состояния биопробы. Штрих-коды, наклеенные неровно, не будут считываться сканерами приборов.
Штрих-код должен быть наклеен ровно и плотно, строго вертикально (длинной стороной вдоль пробирки, контейнера) (рисунок 2).
При маркировке контейнера штрих-код наклеивается непосредственно на сам контейнер, на крышку маркировка не наносится.
Рекомендуется двойная маркировка - помимо штрих-кодирования, на емкость для сбора наносится краткая запись (номер, фамилия, уточнение локализации биоматериала и др.).
Выбор лент со штрих-кодами определяется количеством пробирок, контейнеров для исследований одного пациента, с учетом штрих-кодирования бланка направления (не менее 2-х штрих кодов на ленте: 1-й-на пробирку, 2-й на бланк).
Весь биоматериал маркируется двойными штрих-кодами.
Исключение для исследования:
(63037) «Микробиологическое исследование крови и других стерильных в норме жидкостей на микрофлору»
Необходимо использовать тройной штрих-код:
1 – направление-бланк на исследование
2 – аэробный флакон
3 – анаэробный флакон

Общие требования к условиям хранения проб биоматериала до доставки в лабораторию
Соблюдайте условия хранения биопроб до доставки в лабораторию (таблица 1).
Рекомендуется организовать в отделениях медицинской организации место хранения биопроб до их отправки в лабораторию (таблица 2).
Место хранения биопроб должно иметь маркировку знаком «Биологическая опасность».
Биопробы необходимо хранить в закрывающихся контейнерах, имеющих маркировку знаком «Биологическая опасность».
Регулярно проводите дез.обработку места хранения биопроб, контейнеров.
Сопроводительные документы (бланки направлений на исследования) помещают в пластиковый пакет (файл) для исключения контакта с биоматериалом.
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Рекомендации по организации места хранения биопроб до доставки в лабораторию
Температурный режим хранения, и др.
Место хранения биопроб
при комнатной температуре
(18—20°С), в тёмном месте
Закрытый «холодный» шкаф, тумбочка вдали от отопительных приборов
В закрытом контейнере для доставки
при температуре 2-8 0 С
В термоконтейнере с хладоэлементами
при температуре 37 0 С
В контейнере с термоэлементами, нагретыми до необходимой температуры (грелка, обернуть одноразовой пеленкой, ветошью)
Общие требования к доставке проб биоматериала для микробиологического исследования
Доставка проб биоматериала осуществляется в рабочие дни и время ЛКМ (бактериологии), согласно режиму доставки в ЛКМ.
Исключение составляет круглосуточный прием от отделений МОКБ следующих биоматериалов:
Пробы ликвора - для проведения реакции латекс-агглютинации и бактериологического посева.
Пробы крови - для посева на стерильность.
Собранный материал доставляют в лабораторию в рекомендуемые сроки (таблица 1).
Доставка биоматериала осуществляется курьером.
Не допускается доставка биоматериала пациентами.
Для доставки биоматериала необходимо использовать закрывающиеся контейнеры, биксы или сумки-холодильники, обязательна маркировка знаком «Биологическая опасность».
Не допускается доставка биоматериала в руках, карманах, хозяйственных сумках и других предметах личного пользования.
Дно контейнеров должно быть покрыто сухим адсорбирующим материалом (марлевая салфетка, ткань, вата и пр.).
Доставляемые емкости с биоматериалами должны быть закрыты пробками, крышками, исключающими выливание содержимого во время транспортирования.
Доставка жидкого биоматериала осуществляется строго в вертикальном положении, в штативах.
Сопроводительные документы (бланки направлений на исследования) помещают в непромокаемый пакет (файл, папка) для исключения контакта с биоматериалом.
Разбор доставленного биоматериала должен проводиться с соблюдением мер предосторожности. Емкости с биоматериалами должны помещаться на поднос или лоток. Персонал должен использовать средства индивидуальной защиты (резиновые перчатки, маску).
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Правила по сбору, доставке и хранению различных проб биоматериала для микробиологического исследования
Пробы при инфекционно-воспалительных процессах дыхательных путей
Пробы при инфекционно-воспалительных процессах мочеполовой системы
Общие требования к сбору, хранению и доставке проб биоматериала для ПЦР-диагностики
Правила по сбору, доставке и хранению различных проб биоматериала для ПЦР-диагностики
Читайте также:

