В полу разбавленном растворе полимеров
Обновлено: 18.04.2024
РАСТВОРЫ ПОЛИМЕРОВ, обладают рядом особенностей по сравнению с р-рами низкомол. в-в из-за св-в макромолекул: больших размеров, широкого диапазона гибкости (жесткости), большого набора конформаций, способности к конформац. перестройкам при изменении т-ры, р-рителя и т.п.
Др. особенность растворов полимеров-понижение совместимости компонентов из-за того, что энтропия смешения D S с снижается при соединении мономеров в единую цепь. Полное смешение полимеров с низкомол. р-рителями возможно лишь в определенном интервале т-р. Вне этого интервала взаимная р-римость компонентов становится ограниченной и происходит разделение растворов полимеров на две фазы, сосуществующие в равновесии.
На гипотетич. обобщенной диаграмме р-римости в координатах концентрация полимера с-т-ра T (рис. 1) имеется кривая (бинодаль), отделяющая замкнутую область т-р и концентраций, внутри к-рой раствор полимеров расслаивается на две фазы. Максимум и минимум на бинодали определяют верхнюю и нижнюю критич. т-ры смешения (соотв. ВКТС и НКТС) и критич. концентрации. В критич. точках составы сосуществующих фаз полимер - р-ритель совпадают. При т-рах вне интервала ВКТС-НКТС имеет место неограниченное взаимное смешение компонентов, причем ниже НКТС - за счет сильного взаимод. активных атомных групп полимера и р-рителя, напр. за счет водородных связей. Вблизи критич. т-ры перехода жидкость-пар (НКТС') также имеется область ограниченной совместимости.
Реальная полная диаграмма р-римости полимера с тремя критич. т-рами до сих пор не получена. Наиб. часто проявляется на практике лишь ВКТС (хотя она может лежать выше точки кипения р-рителя), а НКТС не достигается, чаще всего из-за высокой т-ры замерзания р-рителя. Имеются и системы, в к-рых существует лишь НКТС.
Форма и положение бинодали для данной пары полимер -р-ритель зависит от мол. массы. С ростом мол. массы М полимера бинодаль смещается в сторону малых концентраций и больших т-р, критич. концентрация с кр ~ 1/М 1/2 , 1/Т кр линейно убывает с убыванием 1/М 1/2 (пунктирная линия на рис. 1), т.е. р-римость полимера уменьшается. Такая зависимость используется для фракционирования полимеров по мол. массе. Предельное значение Т кр при М : со определяет т. наз. 9-температуру Флори ( q -точку, q -усло-вие) как идеальную т-ру, при к-рой клубкообразные макромолекулы в р-ре имеют конформацию гауссова клубка, т. е. их средний квадратичный линейный размер R пропорционален М 1/2 , а с 0 ~ 1/М 1/2 . С ростом т-ры размеры макромолекулы в разб. р-рах увеличиваются до R ~ М 0,6 , с 0 ~ М - 0,8 (р-ритель "улучшается"). Предельная концентрация с 0 убывает с ростом мол. массы полимера, а при данной мол. массе-с ростом т-ры.
Рис. 1. Обобщенная диаграмма р-римости для системы аморфный полимер— р-ритель. На осях отложены концентрация полимера с и т-ра Т. Кривые 1 и Г — бинодали, ВКТС, НКТС и НКТС'-соотв. верхняя и две нижние критич. т-ры смешения; пунктирная кривая 2 показывает смещение бинодали 1 при увеличении мол. массы полимера.
Теория, позволяющая определить пределы совместимости полимера и р-рителя в зависимости от мол. массы растворенного в-ва и т-ры, развита П. Дж. Флори и М. Хаггинсом в 40-х гг. 20 в. Энтропия смешения D S c системы полимер-р-ритель рассчитывалась на основе решеточной модели (см. Жидкость), согласно к-рой жидкость м.б. представлена квазирешеткой, в каждой ячейке к-рой может помещаться либо молекула р-рителя, либо равный ей по размерам участок макромолекулы, что связано с конкретной конфор-мацией цепи. Соответственно при расчете энтропии смешения D S c принимаются во внимание лишь допустимые кон-формации, а при малой молярной доле полимера в р-ре возможны большие значения D S c . Наличие отличной от нуля теплоты смешения D H с обусловлено тем, что энергия межмол. взаимод. в чистых в-вах-р-рителе и полимере— отличается от энергии взаимод. р-ритель-полимер. Избыточная своб. энергия взаимод., приходящаяся на одну молекулу р-рителя в растворе полимеров, характеризуется полуэмпирич. параметром Флори-Хаггинса c , к-рый для данной пары полимер - р-ритель является ф-цией т-ры. С параметром X связан второй вириальный коэф. А 2 разложения осмотич. давления р-ра в ряд по концентрации, позволяющий оценить "качество" р-рителя. Если контакты полимер - полимер и р-ритель - р-ритель энергетически менее выгодны, чем контакты полимер-р-ритель, коэф. А 2 > 0, р-ритель считается хорошим. Р-рители с А 2 < 0 считаются плохими, р-ри-мость полимера в них ограничена. При А 2 = 0 р-ритель наз. квазиидеальным или q -растворителем, а т-ра, при к-рой положит. энтальпия смешения компенсируется возрастанием энтропии, является q -точкой. Для растворов полимеров q -точка аналогична точке Бойля для реальных газов (см. Вириальное уравнение).
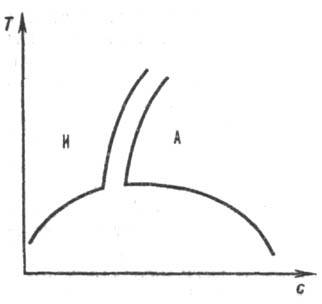
Для жесткоцепных полимеров (напр., при длине жесткого сегмента 10 нм и выше) наблюдается ухудшение р-римости сравнительно с гибкоцепными полимерами, совместимость компонентов растворов полимеров часто достигается за счет сильных взаимод. полимер-р-ритель. Р-римость полимера повышается при наличии у макромолекул подвижных боковых групп атомов. Р-ры жесткоцепных полимеров изотропны лишь при концентрации ниже нек-рой критической, при повышении концентрации на диаграмме р-римости наблюдается узкая область двухфазного состояния, а затем состояние полимерного жидкого кристалла (рис. 2). В изотропных растворах полимеров вязкость сильно возрастает с концентрацией, в жидких кристаллах макромолекулы ориентационно упорядочены, что обеспечивает уменьшение вязкости.
Рис. 2. Равновесная кривая сосуществования фаз в системе полимер ^р-ритель. По осям отложены концентрация полимера с и т-ра Т. Буквами И и А обозначены области существования изотропного и анизотропного р-ров соответственно.
Биол. макромолекулы (белки, нуклеиновые к-ты) и их модели (полипептиды, полинуклеотиды) в р-рах могут иметь специфич. конформации, стабилизированные внутри-мол. взаимодействием . Так, нативные глобулярные конформации белков в водном р-рителе стабилизированы водородными связями и гидрофобными взаимодействиями неполярных групп атомов. Полярные группы на пов-сти глобулы обеспечивают ее р-римость. При изменении состава и св-в р-рителя, рН и ионной силы р-ра или при изменении т-ры происходят внутримол. конформац. переходы типа спираль-клубок и глобула-клубок, что приводит к резкому изменению всех св-в раствора полимеров.
Лит.: Цветков В. Н., Эскин В. Е., Френкель С. Я., Структура макромолекул в растворах, М., 1964; Папков С. П., Равновесие фаз в системе полимер-растворитель, М., 1981; Жен П.-Ж., Идеи скейлинга в физике полимеров, пер. с франц., М., 1982. Т. М. Бирштейн.
Практический интерес представляет рассмотрение вопроса об адсорбции полимеров на твердой поверхности из полуразбавленных и концентрированных растворов, т.е. тех растворов, которые используются на практике. Эти растворы имеют собственную структуру, что будет оказывать влияние на процесс адсорбции.
При повышении концентрации статистические клубки начинают сближаться (касаться друг друга) и перекрываться (полуразбавленный раствор и концентрированный раствор). В результате этого происходит сжатие клубков и уменьшение их размеров. Переход от полуразбавленного раствора к концентрированному означает, что происходит перепутывание клубков, макромолекулы переходят к своим невозмущенным размерам, т.е.
Степень сближение гидродинамического объема макромолекулы является мерой области перехода между двумя концентрациями растворов (полуразбавленного и концентрированного). Полуразбавленные растворы – это растворы, в которых макромолекулы клубка перекрываются, но объемная доля (Ф) мала: Ф *
Для статистических клубков макромолекулы критическая концентрация перекрывания составляет
где NA – число Авогадро, h – характеристическая вязкость, связанная с радиусом вращения цепи.
Было установлено, что для каждой концентрации раствора полимера соответствуют свои размеры адсорбирующихся частиц. Адсорбция полимеров из полуразбавленных растворов происходит отдельными макромолекулами и агрегатами. Из концентрированных растворов молекулы полимера адсорбируются в виде агрегатов-ассоциатов макромолекул.
Взаимодействие клубков полимеров в растворах приводит к возникновению агрегатов макромолекул. Эти агрегаты представляют собой роевые образования взаимодействующих друг с другом клубков макромолекул с определенной продолжительностью жизни.
Термодинамической причиной образования агрегатов может быть неполная термодинамическая совместимость фракций различной молекулярной массы даже одной химической природы. Известно, что низкомолекулярные фракции легче растворяются и характеризуются меньшей способностью к суммированию сил притяжения. Такие агрегаты не являются коллоидными частицами, не имеют границы раздела с растворителями, т.е. не являются самостоятельными фазовыми частицами.
Агрегатами (ассоциатами) называют молекулярные образования-частицы, размеры которых изменяются при воздействии температуры, концентрации и других переменных (их размер 400-2000 А). Система, содержащая агрегаты является однофазной.
Образование агрегатов приводит к тому, что адсорбция макромолекул из полуразбавленных и концентрированных растворов происходит агрегатами. Это объясняется снижением их растворимости с увеличением массы полимера. В полуразбавленных растворах агрегаты образуются из небольшого количества молекул.
Адсорбированные агрегаты имеют не прочную связь с поверхностью твердого тела (адсорбентом), т.к. с ней взаимодействует только часть соприкасающихся с поверхностью молекул, входящих в агрегат. Величина адсорбции из полуразбавленных растворов на много больше, чем из разбавленных. Это связано с тем, что из разбавленных растворов макромолекулы адсорбируются в изолированном виде и крепятся к поверхности сегментами (клубки, петли), а из полуразбавленных растворов – в основном агрегатами различной величины.
С увеличением роста концентрации раствора возрастает размер агрегата, что приводит к увеличению адсорбции, увеличивается концентрация полимера в адсорбционном слое.
Для концентрированных растворов важную роль играет качество растворителя. Из «плохого» растворителя полимеры легче высаживаются на поверхность адсорбата и адсорбция молекул происходит в виде агрегатов. При ухудшении качества растворителя в концентрированных растворах усиливаются межмолекулярные взаимодействия, что приводит к образованию агрегатов и изменению конформации цепи. Агрегация надмолекулярных структур полимеров обусловлена образованием водородных и химических связей. Природа полимера оказывает существенное влияние на образование агрегатов. Раствор поливинилового спирта состоит из агрегатов размером 0,005-0,2 мкм. Они являются прочными и не разрушаются даже при высоких температурах. Большинство полимеров (полистирол, полиакрилонитрил, поливинилацетат) характеризуются существованием агрегатов даже в разбавленных растворах. Размер агрегатов зависит от природы полимера, его молекулярной массы, концентрации полимера в растворе, качества растворителя. Чем выше концентрация полимера и его молекулярная масса, тем больше размер агрегата.
На величину адсорбции существенное влияние оказывает температура и чем выше концентрация раствора полимера, тем выше ее влияние. С повышением температуры возрастает броуновское (тепловое) движение макромолекул, что приводит к разрушению агрегатов в разбавленных, полуразбавленных растворах и уменьшению размеров агрегатов в концентрированных растворах. Это способствует снижению межагрегатных взаимодействий и переходу агрегатов на поверхность адсорбента, а, следовательно, к уменьшению адсорбции. Таким образом два фактора являются определяющими адсорбцию с ростом температуры:
– снижение размеров агрегатов;
– снижение межагрегатных взаимодействий.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Теоретически рассмотрено взаимодействие капель полуразбавленных растворов полимеров с суспензиями. Выведены уравнения, описывающие изменение во времени размеров капель, набухающих в жидкой фазе суспензий и энергии взаимодействия капель с частицами твердой фазы суспензий. Предложены подходы к описанию процесса флокуляции суспензий с использованием выведенных уравнений. При включении в рассмотрение межфазных границ капля-жидкая фаза и капля-частица правильно описываются наблюдаемые на опыте закономерности флокуляции суспензий, такие, как существование оптимального времени контактирования, оптимальной концентрации раствора флокулянта, возможность флокуляции при одноименном заряде полимера и частиц твердой фазы суспензий, дефлокуляция.
Похожие темы научных работ по физике , автор научной работы — А. А. Литманович
Флокуляция модельных дисперсных систем природными полисахаридами, ионогенными сополимерами акриламида и гибридами на их основе
Сопоставительный анализ флокулирующих активностей (по охре) ряда водорастворимых (со)полимеров при разовом и дозированном введении флокулянтов
ON THE FLOCCULATION THEORY. USE OF SEMI-DILUTE POLYMER SOLUTIONS
The interaction between drops of semi-dilute polymer solutions and suspensions are theoretically considered. Equations describing the changes in time of the droplet sizes, suspensions swelled in liquid phase and energy of interaction between droplets and particles of solid phase of suspensions are derived. The approaches to the description of the suspension flocculations using equations derived are suggested. The regularities of the flocculation of suspensions observed experimentally (existence of the optimum contact time, optimum concentration of the flocculant solution, flocculations at the same charge signs of polymer and particles of solid phase of suspensions, deflocculation) are described correctly when droplet-liquid phase and dropletparticle interfaces are taken into consideration.
Текст научной работы на тему «К теории флокуляции. Использование полуразбавленных растворов полимеров»
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ, серия Б, 1993, том 35. № 7
К ТЕОРИИ ФЛОКУЛЯЦИИ. ИСПОЛЬЗОВАНИЕ ПОЛУРАЗБАВЛЕННЫХ РАСТВОРОВ ПОЛИМЕРОВ
© 1993 г. А. А. Литманович
Московский автомобильно-дорожный институт 125829 Москва, Ленинградский пр., 64 Поступила в редакцию 08.09.92 г.
Теоретически рассмотрено взаимодействие капель полуразбавленных растворов полимеров с суспензиями. Выведены уравнения, описывающие изменение во времени размеров капель, набухающих в жидкой фазе суспензий и энергии взаимодействия капель с частицами твердой фазы суспензий. Предложены подходы к описанию процесса флокуляции суспензий с использованием выведенных уравнений. При включении в рассмотрение межфазных границ капля-жидкая фаза и капля-частица правильно описываются наблюдаемые на опыте закономерности флокуляции суспензий, такие, как существование оптимального времени контактирования, оптимальной концентрации раствора флокулянта, возможность флокуляции при одноименном заряде полимера и частиц твердой фазы суспензий, дефлокуляция.
Существует несколько подходов к описанию процесса флокуляции суспензий полимерами. При традиционном рассмотрении принимают во внимание два фактора: снижение абсолютной величины ^-потенциала частиц дисперсной фазы при адсорбции на них противоположно заряженных макромолекул и возможность мостикообра-зования при адсорбции одной макромолекулы на двух или более частицах дисперсной фазы [1, 2]. Недавно предложено рассматривать флокуляцию как результат кооперативного взаимодействия полимеров и коллоидных частиц с привлечением экспериментальных и теоретических методов, развитых для интерполимерных комплексов [3,4].
Каждый йз указанных подходов полезен при анализе определенных технологических процессов, однако с их помощью не удается удовлетворительно объяснить наблюдаемые на опыте явления флокуляции при одноименном заряде макромолекул и частиц дисперсной фазы, а также дефлокуляции, когда механически разрушенные флокулы не восстанавливаются.
Эти явления часто наблюдают при флокуляции грубодисперсных суспензий флотокон-центратов [5] с характерным размером частиц 10 - 100 мкм, существенно превышающим контурную длину макромолекул. В этом случае связь частица-частица должна обеспечиваться ансамблем макромолекул, поэтому для флокуляции таких суспензий необходим принципиально иной подход.
Он заключается в использовании не предельно разбавленных, а полуразбавленных растворов полимеров (ПРП), в которых клубки переплетены. В процессе перемешивания с суспензией такой раствор будет сначала дробиться на капли, причем можно, в принципе, подобрать режим перемешивания и концентрацию раствора так, чтобы количество макромолекул в капле было сравнимо с их количеством в ансамбле, и тогда на частицах будут сразу адсорбироваться ассоциаты макромолекул нужного размера. Но прежде чем рассматривать адсорбцию отдельных цепей или их ассоциатов на частицах, необходимо рассмотреть трехфазную систему ПРП-жидкая фаза сус-
пензии (ЖФС)-твердая фаза суспензии (ТФС), что и является целью данной работы.
Будем считать, что ЖФС непрерывна и идентична растворителю ПРП, а остальные фазы дисперсны, причем ТФС характеризуется размером частиц R, а капли ПРП - размером капель г и объемной долей полимера Ф (для простоты можно считать, что используется эмульсия ПРП с начальным размером капель г0 и объемной долей полимера в них Ф0).
Приравнивая показатели степени при массе, времени и длине, получаем
dm/dt = П r3D~kl (2)
Далее, используя известные выражения Пи Dk через Ф [6], выражая т через г и интегрируя уравнение (2) с учетом зависимости Ф от г, получаем
г = r0 (1 + 3\Ф01/х)1/3v . (3) Ф = Ф0(1 + ЗуФ0Г/Х)"'/у (4)
П = (кТ/а) Ф>1" (1 + ЗуФ0//т) "Vn/V, (5)
где а - длина звена полимера, т = (pa2/3vn) -масштаб времени рассматриваемой системы, р и Т| - плотность и вязкость растворителя, v = vn + v^, vn и v^ - показатели степени при Ф в скейлин-говых соотношениях для осмотического давления и радиуса корреляции ПРП (для хорошего растворителя vn = 9/4, v^ = -3/4, v = 3/2 [6]).
Уравнения (3) - (5) справедливы, пока раствор остается полура.бавленным (Ф > Ф*) и капля сохраняется как целое, причем время жизни капли t*, как несложно убедиться, при фиксированном Ф0 зависит от степени полимеризации Р как
Рассмотрим теперь взаимодействие капель ПРП с частицами ТФС. Поверхностное натяжение на границе ПРП-ТФС а определяется соотношением Жоани-Лейблера [6]
где о0 - поверхностное натяжение на границе ЖФС-ТФС. Отсюда в зависимости от соотношения размеров частицы и капли энергия контакта Есоставляет
' кТ(г0/а)2Фц (1 + ЗуФ^/х) (2/3у)
Уравнения (8а), (86), описывающие изменение во времени энергии взаимодействия капель с частицами, позволяют проанализировать процесс флокуляции суспензий полуразбавленными растворами полимеров. Рассмотрим два возможных подхода к описанию этого процесса.
Первый подход базируется на предположении, что равновесное количество контактов капля-частица, соответствующее Е, устанавливается быстро и эволюция системы во времени определяется только зависимостью Е<(). Иными словами, число частиц ТФС, входящих во флокулы,
где А - суммарная поверхность капель.
В рамках этого подхода получают обоснование следующие явления, наблюдавшиеся при флокуляции суспензий [5].
1. Существование оптимального времени контактирования флокулянта с суспензией. Действительно, й растет во времени, а Е - уменьшается, при этом, согласно уравнению (9), Щ проходит через максимум.
2. Существование оптимальной концентрации раствора флокулянта, подаваемого в суспензию. Это следует из того, что в режиме (8а) максимальная эффективность флокуляции растет как
Ф¿/5 (Ы, ~ Ф^5), а в режиме (86) - убывает как
Ф~1/3. В то же время при фиксированной эффективности перемешивания исходного ПРП с суспензией он дробится на тем более крупные капли, чем больше Ф0. Поэтому эффективность флокуляции максимальна при таком Ф0, когда начальные размеры капель сравнимы с размерами частиц ТФС, т.е. г0 ~ Я.
3. Возможность флокуляции при одноименном заряде полимера и частицы ТФС, что, безусловно, очевидно для случая, когда Е больше, чем энергия электростатического отталкивания.
4. Дефлокуляция, т.е. меньшая эффективность повторной флокуляции после механического разрушения первоначально образовавшихся флокул. Этот процесс логично связать с полным рассасыванием капель ПРП, при этом повторное образование флокул будет менее эффективным, так как не будет вклада поверхностного натяжения.
Второй подход связан с моделированием процесса флокуляции трехмерной поликонденсацией, причем частица ТФС рассматривается как /-функциональный, а капля ПРП - как бифунк-
К ТЕОРИИ ФЛОКУЛЯЦИИ
где N и К- количество частиц и капель в единице объема суспензии, а и (3 - константы скорости образования и разрушения контактов, причем
Уравнения (10), (11), как и уравнения (8), (9), описывают экстремальную зависимость эффективности флокуляции во времени: вначале к увеличивается, а затем по мере роста Р по сравнению с а - уменьшается. Кроме того, в отличие от первого подхода, в уравнениях (10), (11) заложена зависимость времени /т достижения максимального количества контактов кт и величины кт от концентрации суспензии. Наконец, для каждого момента времени и достигнутого числа контактов можно рассчитать средние размеры флокул и другие характеристики процесса, используя имеющийся математический аппарат теории трехмерной поликонденсации [8].
Таким образом, включение в рассмотрение процесса флокуляции межфазных границ ПРП-ТФС и ПРП-ЖФС позволяет описать важнейшие наблю-
дающиеся на практике закономерности. Развитый здесь подход относится к начальной стадии флокуляции, дальнейшая эволюция образовавшихся флокул связана с адсорбцией ассоциатов макромолекул из капли на поверхности частиц ТФС.
1. Кузькин С.Ф. Синтетические флокулянты в процессах обезвоживания. М.: ГНТИ, 1963. С. 93.
2. LaMer V., Healy T. // Rev. Pure and Appl. Chem. 1963. V. 13. P. 112.
3. Касаикин В Л. Дис. д-ра хим. наук. M.: МГУ, 1988.
4. Hul'chaev Н.Н., Agamalyan M.M., Alexeev V.L., Evmenenko GA„ Kasaikin V.A., Zezin A.B. The Flocs Internai Structure of Silicia-Sol and Synthetic Polyamines Colloid-Polyelectrolyte Complexes. Preprint N. 1656 of LNTI, Leningrad, 1990.
5. Небера В.П. Флокуляция минеральных суспензий. M., 1983. С. 7.
6. Де Женн П. Идеи скейлинга в физике полимеров. М.: Мир, 1980. С. 73.
7. Касаткин А.Г. Основные процессы и аппараты химической технологии. М.: Химия, 1973. С. 64.
8. Yan J.F. // J. Chem. Phys. 1983. V. 78. P. 6893.
On the Flocculation Theory. Use of Semi-Dilute
A. A. Litmanovich
Moscow Auto-Road Institute, Pr. Leningradskii 64, Moscow, 125829 Russia
Abstract - The interaction between drops of semi-dilute polymer solutions and suspensions are theoretically considered. Equations describing the changes in time of the droplet sizes, suspensions swelled in liquid phase and energy of interaction between droplets and particles of solid phase of suspensions are derived. The approaches to the description of the suspension flocculations using equations derived are suggested. The regularities of the flocculation of suspensions observed experimentally (existence of the optimum contact time, optimum concentration of the flocculant solution, flocculations at the same charge signs of polymer and particles of solid phase of suspensions, deflocculation) are described correctly when droplet-liquid phase and droplet-particle interfaces are taken into consideration.
Аннотация научной статьи по химическим наукам, автор научной работы — Ю. С. Липатов, В. Н. Чорная, Т. Т. Тодосийчук, Т. С. Храмова
Проведено систематическое исследование адсорбции из растворов смесей несовместимых полимеров полистирола и полидиметилсилоксана в общем растворителе (этилацетате) в области кроссовера. Представлены изотермы адсорбции из индивидуальных растворов и их смесей в концентрационном интервале до и после критической концентрации перекрывания полимерных клубков. Для объяснения полученных изотерм определены параметры термодинамического взаимодействия полимер растворитель, 'невозмущенные размеры макромолекул в данном растворителе, размеры агрегатов полимеров в зависимости от концентрации раствора. Показано, что максимальная агрегация наблюдается в области до критической концентрации. При достижении критических концентраций степень агрегации резко уменьшается вследствие сжатия полимерных клубков.
Похожие темы научных работ по химическим наукам , автор научной работы — Ю. С. Липатов, В. Н. Чорная, Т. Т. Тодосийчук, Т. С. Храмова
Кинетика адсорбции полибутилметакрилата из индивидуальных растворов и смесей с полистиролом в четыреххлористом углероде и структура адсорбционного слоя
ADSORPTION OF POLYMER MIXTURES FROM DILUTE AND SEMIDILUTE SOLUTIONS
Adsorption of mixtures of incompatible polymers (polystyrene and polydimethylsiloxane) from solutions in the general solvent (ethyl acetate) in the crossover region has been studied. The adsorption isotherms from particular solvents and their mixtures in the concentrations range before and after overlapping of polymer coils are presented. The parameters of the thermodynamic interaction polymer solvent, unperturbed dimensions of macromolecules in the given solvent and dimensions of polymer aggregates have been determined for various concentrations of solution. The maximal aggregation is observed in the region of critical concentrations and then the degree of aggregation is sharply decreased as a result of compression of polymer coils.
Текст научной работы на тему «АДСОРБЦИЯ СМЕСЕЙ ПОЛИМЕРОВ В РЕЖИМЕ РАЗБАВЛЕННОГО И ПОЛУРАЗБАВЛЕННОГО РАСТВОРА»
© 1990 г. Ю. С. Липатов, В. Н. Чорная, Т. Т. Тодосийчук,
АДСОРБЦИЯ СМЕСЕЙ ПОЛИМЕРОВ В РЕЖИМЕ РАЗБАВЛЕННОГО И ПОЛУРАЗБАВЛЕННОГО РАСТВОРА
Проведено систематическое исследование адсорбции из растворов смесей несовместимых полимеров полистирола и полидиметилсилоксана в общем растворителе (этилацетате) в области кроссовера. Представлены изотермы адсорбции из индивидуальных растворов и их смесей в концентрационном интервале до и после критической концентрации перекрывания полимерных клубков. Для объяснения полученных изотерм определены параметры термодинамического взаимодействия полимер - растворитель, 'невозмущенные размеры макромолекул в данном растворителе, размеры агрегатов полимеров в зависимости от концентрации раствора. Показано, что максимальная агрегация наблюдается в области до критической концентрации. При достижении критических концентраций степень агрегации резко уменьшается вследствие сжатия полимерных клубков.
Молекулярно-агрегативный механизм адсорбции полимерных молекул из растворов на твердых поверхностях связывает особенности адсорбции с состоянием полимерной цепи в растворе. Последнее, как известно, зависит от термодинамического качества растворителя, температуры и концентрации раствора, определяющих появление в определенной области концентраций макромолекулярных агрегатов, находящихся в равновесии с изолированными молекулами. Переход от адсорбции изолированных молекул к адсорбции агрегатов, происходящий в определенной области концентраций, существенно изменяет изотерму адсорбции.
С этой точки зрения существенным является рассмотрение адсорбции из растворов смесей полимеров, характеризующихся различной величиной критической концентрации с\ где начинается переход от режима разбавленного раствора к полуразбавленному [1—4].
Режим разбавленного раствора предусматривает существование отдельных макромолекул и практически отсутствие межмолекулярного взаимодействия между ними; для разбавленного раствора концентрация данного полимера с
В случае полуразбавленного раствора с < 1, но с/с*>1, что приводит к перекрыванию молекулярных клубков (при с=с*) и дальнейшему их сжатию при с>с* вследствие усиления межмолекулярного взаимодействия в растворе при повышении его концентрации. В концентрированных растворах с=1 и с/с*» 1 и при этом степень перекрывания клубков достаточно высока.
Для определения с* были предложены различные теоретические модели. В общем случае с* пропорционально [т]]-1, где [г|] — характеристическая вязкость, а коэффициент пропорциональности зависит от выбранной модели взаимодействия клубков [5—7].
Эффекты перекрывания цепей и агрегации макромолекул особенно существенны в случае адсорбции из раствора смесей полимеров, растворенных в общем растворителе, но термодинамически в нем несовместимых.
Цель настоящей работы — выяснение влияния состояния раствора на адсорбцию смеси полимеров. Исследование процессов адсорбции и агрегации выполнено для области кроссовера от разбавленного раствора к полуразбавленному. Нами впервые проведено исследование адсорбции смеси
двух полимеров из растворов в общем растворителе в тех концентрационных областях для каждого компонента смеси, в которых концентрация раствора для данного полимера сс* (режим полуразбавленного раствора).
Объектами исследования служили ПС с Л/„=2,7105 и ПДМС с М„=3,2-103. В качестве растворителя использовали этилацетат и бензол, которые перед проведением исследований очищали и перегоняли по стандартной методике [8]. Адсорбционные исследования проводили на аэросиле (удельная поверхность 300 м2/г). Перед проведением адсорбционных опытов аэросил прокаливали при 973 К в муфельной печи в течение 6 ч для удаления физически связанной воды.
Характеристическую вязкость определяли вискозиметрическим методом по стандартной методике [9] с использованием вискозиметра Уббелоде.
Агрегацию в растворах ПС изучали методом спектра мутности [10] по спектральной зависимости оптической плотности рассеянного света 1>=Й(А,), которую снимали на спектрофотометре «вресогс! иУ-У18» в видимой области спектра. Растворы ПДМС в исследуемой области спектра являются прозрачными, вследствие чего агрегацию в них не оценивали.
Величину адсорбции А рассчитывали по разности исходной и конечной концентраций полимера, определенных методом ЯМР высокого разрешения. Этим же методом определяли долю заторможенных сегментов цепи по формуле
Значения критических концентраций исследуемых полимеров в двух растворителях получали вискозиметрическим методом по соотношению с*=1/[т11-
В табл. 1 приведены значения [г|] и с* для изученных бинарных систем, а также значения параметров и А2, характеризующих термодинамику взаимодействия в системах [12].
Для этих систем по концентрации перекрывания клубков с учетом высокой кинетической гибкости цепи ПДМС рассчитаны размеры макромолекул по уравнению [13] для области кроссовера от разбавленных растворов к полуразбавленным
Таким образом, особенности агрегации в области кроссовера заключаются в следующем: если увеличение концентрации раствора ПС в области разбавленного раствора обусловливает закономерное увеличение размеров агрегатов и их количества в единице объема, то в области перехода к полуразбавленным и далее к концентрированным растворам размер агрегатов уменьшается, приближаясь к невозмущенным размерам макромолекул [13]. Это может быть связано с интенсивным перекрыванием и сжатием макромолекулярных клубков [5] и дальнейшим образованием гидродинамической сетки, препятствующей процессу агрегации.
Полученные для ПС экспериментальные данные об агрегации и о величине с* для обоих полимеров позволяют объяснить некоторые особенности адсорбции ПС и ПДМС из индивидуальных растворов и растворов смесей в общем растворителе этилацетате.
Характеристика термодинамического состояния и величин для исследуемых систем, 295 К
Бинарная система А2.ю4, МОЛЬ-' Хк [»>], 100 см3/г с*, г/100 см3
Бензол - ПДМС Бензол — ПС Этилацетат - ПДМС Этилацетат - ПС 3,8 6,0 2,6 0,8 0,46 0,43 0,47 0,49 0,12 0,85 0,11 0,46 8,3 1,2 9,0 2,2
Невозмущенные размеры макромолекул
Бинарная система (^МО. НМ Бинарная система -2 Чг (Л0) 10, нм
ПС - бензол 6000 ПДМС - бензол 75
ПС — этилацетат 500 | ПДМС - этилацетат 70
Размеры агрегатов ПС в этилацетате в зависимости от концентрации
Концентрация раствора, г/100 см3 Размер агрегатов гш, А Количество N10-", см-3 Концентрация раствора, г/100 см3 Размер агрегатов гш, А Количество N•10-«, см-3
0,25 1000 0,017 2,50 850 5.04
0,50 2000 0,08 3,00 890 5,90
1,00 3000 0,10 5,00 890 6,88
1,50 4000 0,27 7,00 890 7,14
2,00 800 4,40 8,00 900 7,64
На рис. 1, 2 представлены изотермы адсорбции ПДМС и ПС из индивидуального раствора и их смесей, когда концентрация одного из полимеров остается постоянной (сс"), в то время как концентрация другого полимера непрерывно изменяется. Как видно из рис. 1, изотерма адсорбции ПДМС из индивидуального раствора (кривая.?) представляет собой кривую с максимумом в области кроссовера при с^с*. Введение ПС в концентрациях до 0,5 г/100 см3 (спс<Спс*) приводит к значительному уменьшению величины адсорбции ПДМС (кривая 2), при этом максимум на изотерме ПДМС сохраняется при тех же концентрациях, что и в случае индивидуального полимера; увеличение количества ПС в смеси до 1,0 г/100 см3 (спс<спс") (кривая 3), вызывая дальнейшее уменьшение адсорбции, одновременно вызывает смещение максимума на изотерме ПДМС в область меньших концентраций. Аналогичная зависимость наблюдается при введении ПС в концентрации, равной с* (2,5 г/ /100 см3 (кривая 4)).
Величина адсорбции ПДМС при его концентрациях выше с* уменьшается во всех случаях (кривые 1—3), как в случае индивидуального ПДМС, так и для его смеси с ПС. Одновременно в исследуемых системах наблюдается незначительная адсорбция и ПС (табл. 4). При этом в смеси ПДМС и ПС при концентрации последнего с>с* адсорбции как ПДМС, так и ПС пе наблюдается. В смеси, содержащей 2,5 г/100 см3 ПС (с>с*), в области концентраций ПДМС 11 г/100 см3 и выше (с>с*) система обнаруживает четко выраженное расслоение на фазы с различным содержанием компонентов, что было установлено методом ЯМР-спектросконии, когда по ин-
Рис. 1. Изотермы адсорбции ПДМС на аэросиле из индивидуального раствора (1) и из смеси с ПС в этилацетате <2-4) при спс=0,5 (2); 1,0 (3) и 2,5 г/100 см3 (4) и сПдмс=9,0 г/100 см'
2,0 Спс, г ¡100 см3
Рис. 2. Изотермы адсорбции ПС на аэросиле из индивидуального раствора (2) и из смеси с ПДМС в этилацетате (2-4) при сПдмс=0,5 (2); 1,0 (3) и 9,0 г/100 см3 (4) и епс*=2,2 г/100 см3
•гегральной интенсивности сигналов определялась концентрация ПС и ПДМС в каждой фазе.
Полученные данные о влиянии ПС на адсорбцию ПДМС (рис. 1) являются необычными для случая термодинамически несовместимых полимеров. Как правило, ухудшение термодинамического качества полимерного растворителя, наблюдающееся для системы ПС — ПДМС — этилацетат [12], должно приводить к увеличению адсорбции. Наблюдаемое нами уменьшение адсорбции объясняется тем, что при с>с* образующаяся в растворе ПДМС вследствие интенсивного перекрывания полимерных клубков гидродинамическая сетка препятствует переходу макромолекул и их агрегатов на поверхность адсорбента. Кроме того, как следует из данных работ [14—16], при адсорбции из растворов и их смесей необходимо учитывать конкурирующую адсорбцию растворителя, которая препятствует переходу на. твердую поверхность полимерных молекул, и при этом значительно уменьшается величина адсорбции.
Наряду с влиянием различных количеств ПС на адсорбцию ПДМС из смеси было изучено и влияние ПДМС на адсорбцию ПС. На рис. 2 и
Адсорбция ПС в смеси с ПДМС
сПДМС в смеси, г/100 см3 АПС для смеси, содержащей
0,5 0,007 0,010 0,010
1,0 0,008 0,020 0,03
3,0 0,007 0,017 0,06
5,0 0,010 0,017 0,10
Адсорбция ПДМС из смеси с ПС
-Л-ПДМС из смеси при сПДМС, г/ЮО см3
АПДМС из смеси при СПДМС, г/100 см3
0,015 0,022 0,020 0,028 0,028
1,75 2,00 2,50 3,00 5,00
0.022 0,025 0,022 0,020 0,018
в табл. 5 представлены результаты исследования адсорбции ПС из индивидуального раствора и из смеси с ПДМС, а также величины адсорбции ПДМС. Изотерма адсорбции индивидуального ПС имеет размытый максимум в области концентраций 0,5—0,75 г/100 см3, однако величина адсорбции ПС на порядок меньше такой для ПДМС. Повышение концентрации ПС приводит к снижению величины адсорбции и к ее резкому уменьшению в области с>с*.
Изотерма адсорбции ПС в смеси с ПДМС, когда сПдмсс* (с^2,5 г/100 см3) наблюдается помутнение раствора, что свидетельствует о фазовом расслоении. Дальнейшее увеличение количества ПДМС до 15 г/100 см3(с»спдмс) приводит к расслоению системы уже при малых концентрациях ПС (с<еПс*).
Определенная информация о характере адсорбционного взаимодействия полимера с твердой поверхностью может быть получена в результате определения доли заторможенных звеньев Р в растворах ПС, ПДМС и их смесей в условиях адсорбционного равновесия, когда система исследуется без отделения адсорбента [17]. Поскольку величина Р является характеристикой связывания сегментов поверхностью и свидетельствует о заторможенности молекулярных движений какой-то последовательности звеньев вследствие адсорбции концевого звена этой последовательности на поверхности адсорбента, уменьшение или увеличение доли заторможенных звеньев одного полимера при росте концентрации другого в системе свидетельствует о меньшей или большей связанности первого полимера с твердой поверхностью в данных условиях и о влиянии на эту характеристику второго компонента.
На рис. 3 и 4 представлены зависимости доли заторможенных звеньев ПДМС из индивидуального раствора (рис. 3, кривая 1) и из смеси с различным количеством ПС (кривые 2—4) и ПС (рис. 4, кривая 1) с различным количеством ПДМС (кривые 2—4). Как видно, изменение Р с ростом концентрации раствора аналогично изотермам адсорбции (рис. 1, 2). Максимумы на зависимостях Р от с в случае индивидуального раствора ПДМС (рис. 3) и при содержании ПС 0,5 г/100 см3 в смеси совпадают и наблюдаются при с=с*; с увеличением количества ПС в смеси (1,0 г/100 см3) экстремум на изотерме ПДМС (кривая 3) сдвигается в область его меньших концентраций с
Таким образом, при изучении влияния режима раствора с учетом критической концентрации перекрывания полимерных клубков в смеси термодинамически несовместимых полимеров ПС — ПДМС было установлено, что специфика раствора существенно сказывается как на характере агрегации, так и на характере адсорбции. Агрегация, начинающаяся при определенной концентрации раствора, достигает наибольшей эффективности в области до с*, так как перекрывание клубков при с
Рис. 3. Зависимость Рпдмс от концентрации ПДМС для индивидуального раствора (1) и его смеси с ИС в этилацетате (2—4) при спс=0,5 (2); 1,0 (3) и 2,5 г/100 см3 (4)
Рис. 4. Зависимость Рпс от концентрации ПС для индивидуального раствора (1) и его смеси с ПДМС в этилацетате (2—4) при спдмс=0,5 (2);
1,0 (3) и 9,0 г/100 см3 (4)
в объеме раствора. При достижении критических концентраций степень агрегации резко уменьшается вследствие сжатия полимерных клубков. Установленный характер агрегации позволяет объяснить особенности адсорбции из растворов смеси полимеров в области кроссовера, состоящие в том, что при введении второго компонента в количестве, меньшем его с*, наблюдается адсорбция обоих полимеров; введение второго полимера в количестве, равном с*, в области докритических концентраций первого приводит к адсорбции обоих полимеров; при концентрациях первого, равных и больших его с*, система расслаивается: введение второго полимера в количестве, большем с*, вызывает расслоение системы уже при небольших количествах первого.
Итак, впервые установлена взаимосвязь между агрегацией и адсорбцией из индивидуальных растворов полимеров и их смесей в переходной области из разбавленного к полуразбавленному раствору.
1. Ioan S., Simionescu В. С., Neamtu /., Simionescu С. I. // Polymer Commun. 1986. V. 27. № 4. Р. 113.
2. Кок С. М., Radin А. // Europ. Polymer J. 1982. V. 18. № 4. P. 363.
3. Де Женн П. // Идеи скейлинга в физике полимеров. М., 1982. С. 368.
4. Bouchaud Е., Daoud М.Ц J. Phys. 1987. V. 48. № И. Р. 1991.
5. Weltes D. // J. Chem. Soc. Faraday Trans. I. 1984. V. 80. № 5. Р. 1233.
6. Ying Q., Chu B. // Macromolecules. 1987. V. 20. № 2. P. 362.
7. Simha R„ Frisch U., Eirich F. Ц J. Polymer Sei. 1958. V. 29. № 119. P. 3.
8. Гордон А., Форд Р. Спутник химика. М., 1976. С. 542.
9. Цянь-Женъ-Юань. Определение молекулярных весов полимеров. М., 1976. С. 234.
10. Кленин В. И., Щеголев С. Ю., Лаврушин В. И. Характеристические функции светорассеяния дисперсных систем. Саратов, 1977. С. 176.
11. Липатов Ю. С., Храмова Т. С., Сергеева Л. М., Тодосийчук Т. Т. // Коллоид, журн. 1977. Т. 39. № 1. С. 174.
12. Strazielle С. // Europ. Polymer J. 1979. V. 15. № 1. Р. 55.
13. Subasini L., Padma N., Manoranjan D.//J. Macromolec. Sei. A. 1983. V. 19. № 3. P. 321.
14. Липатов Ю. С., Чорная В. Н., Тодосийчук Т. Т., Храмова Т. С. II Укр. хим. жури. 1988. Т. 54. № 1. С. 90.
15. Chan F. S., Minhas P. S., Robertson A. A. HJ. Colloid Interface Sei. 1970. V. 33. № 4. P. 586.
16. Ashmead В. V., Owen M. J. // J. Polymer Sei. 1971. V. 9. № 2. P. 331.
17. Липатов Ю. С., Храмова Т. С., Тодосийчук Т. Т., Чорная В. Н.Ц Высокомолек. соед. А. 1986. Т. 28. № 3. С. 602.
Институт химии высокомолекулярных Поступила в редакцию
соединений АН УССР 10.02.89
Yu. S. Lipatov, V. N. Chornaya, T. T. Todosiichuk, T. S. Kbramova
ADSORPTION OF POLYMER MIXTURES FROM DILUTE AND SEMIDILUTE SOLUTIONS
Adsorption of mixtures of incompatible polymers (polystyrene and polydimethylsi-loxane) from solutions in the general solvent (ethyl acetate) in the crossover region has been studied. The adsorption isotherms from particular solvents and their mixtures in the concentrations range before and after overlapping of polymer coils are presented. The parameters of the thermodynamic interaction polymer - solvent, unperturbed dimensions of macromolecules in the given solvent and dimensions of polymer aggregates have been determined for various concentrations of solution. The maximal aggregation is observed in the region of critical concentrations and then the degree of aggregation is sharply decreased as a result of compression of polymer coils.
Понимание поведения полимеров в растворе важно для определенных применений, таких как косметические гели и кремы . Можно контролировать вязкость полученного продукта и избегать возможного расслоения (разделения фаз). Установлено, например, что стирол это смешивается в любой пропорции в циклогексане при 20 ° С , но что , когда стирол полимеризуется, то больше не смешиваемость. Эти явления можно объяснить разными теориями.
Резюме
Теория Флори- Хаггинса
Полимерная цепь моделируется набором N звеньев ( мономерных звеньев ) объема a. Среднее количество звеньев связано со степенью полимеризации и молярной массой полимера. Он находится в растворе в растворителе с объемной долей или известной концентрацией.
Смесь полимеров на основе растворителей
Предполагается, что молярный объем мономерных звеньев равен объему молекул растворителя. Смесь можно представить так:
При заданной температуре и давлении свободная энтальпия смешивания должна быть отрицательной, чтобы смешивание происходило. В случае регулярного решения статистические термодинамические расчеты позволяют оценить эту свободную энтальпию:
Для полимера в растворителе Флори спросил:
где N - среднее количество мономерных звеньев в цепи.
Эта свободная энтальпия на самом деле является суммой двух членов:
Когда N или молярная масса (что эквивалентно) увеличивается, энтропия уменьшается, поэтому беспорядок тоже. Действительно, существует меньше возможностей для распределения мономерных звеньев и молекул растворителя на вышеуказанной сетке, когда цепи длиннее. Это приводит к более сложной отрицательной свободной энтальпии смешения, когда полимер имеет более высокую молярную массу. Это согласуется с осаждением, которое можно наблюдать, когда полимер синтезируют в растворе, то есть в растворителе.
Параметр Флори
Параметр, который влияет на выражение энтальпии и, следовательно, свободной энтальпии, позволяет учитывать взаимодействия между полимером и растворителем. В этой модели χ
Это параметр Флори, который играет важную роль в эволюции свободной энтальпии:

Когда параметр Флори увеличивается:, появляется зона расслоения, охватывающая все более широкий диапазон объемных долей. χ 1 < χ против < χ 2 < χ 3 < χ 4 >
От определенного значения кривая имеет две точки перегиба, и можно провести двойную касательную . Это признак двухфазного разделения, такого как: χ

Подводя итог, расслоение возникает, когда параметр Флори превышает критическое значение, которое зависит от молярной массы. Это также можно понять, сравнив взаимодействия, которые появляются в выражении этого параметра. Когда здорово, доминирует. Эта энергия притяжения, конечно, отрицательна, и когда она велика, она уменьшается по абсолютной величине: притяжение между полимером и растворителем ослабевает. Звенья полимерных цепей притягиваются друг к другу, и полимер будет все меньше и меньше растворяться. χ ϵ M S >
К этому параметру Флори можно получить доступ экспериментально, например, путем измерения осмотического давления .
Диаграмма состояний -T ϕДля системы полимер / растворитель, если доминируют ван-дер-ваальсовы взаимодействия лондонского типа (как правило, в неполярной среде ), можно показать, что оно изменяется как величина, обратная температуре. При низкой температуре параметр Флори будет большим и будет расслаивание, и наоборот. χ
С другой стороны, когда преобладают водородные связи (полярная среда), увеличивается с температурой, и поэтому мы имеем противоположную ситуацию. При высокой температуре термическое перемешивание разрывает водородные связи, которые связывают полимер с растворителем, и происходит фазовое разделение. χ
Чтобы получить эти фазовые диаграммы, можно начать с трубок, содержащих различные мольные доли полимера, и наблюдать, когда каждая трубка становится мутной при охлаждении от температуры, при которой она перемешивается. Мутность возникает из-за рассеяния света во всех направлениях частицами, которые появляются при фазовом разделении:
Подход Хильдебранда, параметр растворимости
Мы определяем когезионную энергию системы и плотность когезионной энергии, которая получается делением первой на молярный объем:
Тогда параметр растворимости равен квадратному корню из этой плотности c:
Значения параметров растворимости сведены в таблицу для многих растворителей и полимеров. Мы можем показать, что параметр Флори, рассмотренный ранее, может быть записан:
где R - постоянная идеального газа . Если мы ищем хороший растворитель для данного полимера, мы должны поэтому искать параметр растворимости, близкий к параметру полимера, чтобы минимизировать параметр Флори. Таким образом, можно исключить большое количество растворителей для данного полимера, но даже если параметры Гильдебранда близки, растворимость не гарантируется.
Мы также можем рассчитать параметр растворимости следующим образом:
Осмотическое давление и качество растворителя
Рассмотрим два отсека, разделенных полупроницаемой мембраной :

Правое отделение содержит раствор полимера в растворителе, а левое отделение содержит только растворитель. Между двумя отсеками существует разница в давлении. Более конкретно, полимерные цепи оказывают давление на стенку. Эта сила на единицу площади называется осмотическим давлением . Его можно рассчитать с некоторыми допущениями на основе энтальпии перемешивания, рассмотренной ранее.
Если объемная доля полимера не слишком велика, получаем:
Мы понимаем, что значение параметра Флори снова играет роль:
- если оно больше 1/2, осмотическое давление снижается, что означает меньшее воздействие частиц на стенку и их стремление оставаться между ними. полимер труднее растворяется, мы находимся в плохом режиме растворителя . Однако полимер может быть растворен или осажден :; χ ПРОТИВ > 1 / 2 > 1/2>
- если оно меньше 1/2, осмотическое давление увеличивается, и наоборот: растворитель хорошо растворяет полимер, и мы говорим, что находимся в хорошем режиме растворителя . Если полимер имеет форму шариков, это приведет к разбуханию последнего. Мономер часто является хорошим растворителем для своего полимера, например стирол для полистирола;
- предельное значение соответствует так называемому растворителю (тета), которому соответствует температура . Критическая температура Tc, показанная выше, стремится к этой температуре, когда молярная масса стремится к бесконечности, что позволяет получить доступ путем экстраполяции. χ знак равно 1 / 2 θ θ θ θ
Параметр Флори зависит от температуры. Когда он принимает предельное значение 1/2, соответствующая температура носит название «тета-температура». Эту конкретную температуру часто можно найти в таблицах для пары полимер / растворитель. Так , например, циклогексан является тэта растворитель полистирол 307,2 K . χ
Теория Флори-Кригбаума
Эта теория вводит понятие исключенного объема: существует отталкивание между цепями геометрической природы, которое запрещает присутствие центра масс другой полимерной цепи вокруг данной цепи.

Рассчитанный ранее параметр Флори модифицируется:
χ знак равно χ е нет т час в л п я q ты е п р е ´ против е ´ d е нет т + χ е нет т р о п я q ты е d ты в ты v о л ты м е е Икс против л ты > с > вмятины> + \ хи _ > .
Пара полимер-растворитель может быть связана с температурой и параметром, называемым параметром энтропии , оба независимо от температуры: θ ψ
Зная критическую температуру (начала помутнения) для образцов полимера с различной молярной массой, температуру и параметр энтропии можно определить графически . Т против > θ
Исключенный объем (u), параметр Флори и второй коэффициент Вириеля пары полимер / растворитель A2 связаны следующими соотношениями:
Na - количество авогадро , N - количество сегментов, M - молярная масса и имеет объем мономерного звена.
Когда параметр Флори меньше 0,5, исключенный объем увеличивается: есть удлинение цепей, и мы находимся в хорошем режиме растворителя. В плохом растворителе все наоборот, происходит сжатие цепей. Исключенный объем может быть получен экспериментально с помощью осмометрии.
Режимы концентрации и закон шкалы
Существуют разные режимы, в зависимости от концентрации и массы полимера в растворе. По энтропийным причинам полимерные цепи не разворачиваются, а сжимаются сами по себе, образуя шары .
От разбавленного режима к полуразбавленному режиму
Пусть гранулы полимера находятся в растворе. При увеличении концентрации (или той же объемной доли) расстояние между шариками уменьшается. С момента возникновения контакта между последним и связанной с ним концентрацией называется критическая восстановительная концентрация. Он отмечает переход между разбавленным режимом и полуразбавленным режимом . По-прежнему можно увеличить концентрацию в режиме полуразбавленного раствора, потому что доля полимера, содержащегося в шарике, действительно мала.

Критическую концентрацию извлечения можно рассчитать по следующей формуле:
Объемная доля зависит от количества сегментов цепей в степени -4/5.
Радиус вращения в разбавленном режиме
Это расстояние влияет на физико-химические свойства системы. В хорошем растворителе:
где Rg - радиус вращения шаров, а N - количество сегментов цепи, составляющей шар и имеющей размер этих сегментов. В растворителе : θ
Эту разницу в показателе экспоненты можно понять, приняв во внимание тот факт, что в хорошем растворителе преобладают отталкивающие взаимодействия между сегментами шаров. Шары разбухают, и их радиус вращения увеличивается. χ < 1 / 2
В растворителе есть разные модели для расчета радиуса вращения: θ
где - валентный угол, взятый согласно этому соглашению: θ

- заторможенное вращение: учитываются взаимодействия между молекулярными группами.
Если человек больше не находится в условиях , можно ввести коэффициент объемного расширения следующим образом: θ
Характеристическое значение в полуразбавленном режиме
Когда шары проникают друг в друга, мы больше не можем говорить о радиусе вращения, поскольку мы не можем различить шары. Определяем среднее расстояние между точками запутывания, отметили . Это количество равно критической концентрации извлечения. Затем он уменьшается по мере увеличения концентрации. Свойства системы зависят от этой величины в полуразбавленном режиме. Мы можем показать, что: ξ р грамм >
Запутанный режим
Это возможно, когда масса превышает критическую массу сцепления Mc. Он может появиться в полуразбавленной диете или даже в концентрированной диете (при еще большем увеличении концентрации). В запутанном режиме движение цепей очень затруднено движением других цепей. Его движение описывается ползучей моделью. Вязкость затем зависит от концентрации к мощности 3,75 и кубической массы. В режиме без перепутывания вязкость зависит от концентрации только со степенью 2,5, а цепи имеют так называемую динамику «Роуза». Этот больший или меньший эффект концентрации позволяет значительно влиять на вязкость системы и может использоваться при приготовлении полимерных гелей .
Читайте также:

